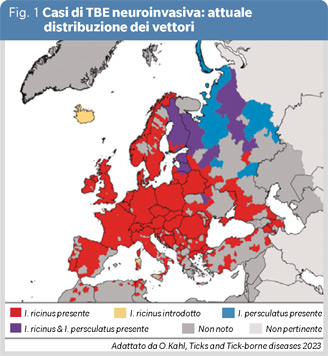
 Nel 2023 sono stati notificati in Italia 50 casi di TBE (tick-borne encephalitis, encefalite virale da zecche), 47 autoctoni e 3 associati a viaggi all’estero, l’età mediana è di 58 anni, il 70% è di sesso maschile, fortunatamente nessun decesso. Il dato è simile a quanto riportato nel 2022, anno in cui sono stati notificati 72 casi con due decessi, ed è in aumento rispetto ai casi notificati negli anni pre-pandemia COVID-19 (1). TBE è causata da un virus del genere Flavivirus (TBEV), di cui conosciamo tre sottotipi, il sottotipo europeo trasmesso dalla zecca Ixodes ricinus, il sottotipo estremo-oriente e il sottotipo siberiano trasmessi principalmente dalla zecca Ixodes persulcatus (Figura 1).
Nel 2023 sono stati notificati in Italia 50 casi di TBE (tick-borne encephalitis, encefalite virale da zecche), 47 autoctoni e 3 associati a viaggi all’estero, l’età mediana è di 58 anni, il 70% è di sesso maschile, fortunatamente nessun decesso. Il dato è simile a quanto riportato nel 2022, anno in cui sono stati notificati 72 casi con due decessi, ed è in aumento rispetto ai casi notificati negli anni pre-pandemia COVID-19 (1). TBE è causata da un virus del genere Flavivirus (TBEV), di cui conosciamo tre sottotipi, il sottotipo europeo trasmesso dalla zecca Ixodes ricinus, il sottotipo estremo-oriente e il sottotipo siberiano trasmessi principalmente dalla zecca Ixodes persulcatus (Figura 1).
L’aumento di incidenza, quasi del 400% in Europa negli ultimi 30 anni, è un fenomeno attribuibile a molteplici fattori, innanzitutto demografici, quali l’invecchiamento della popolazione, sociali (la maggiore mobilità e i viaggi, le più frequenti attività ricreative all’aria aperta, la bassa copertura vaccinale nelle aree endemiche), ambientali (l’impatto del cambiamento climatico sulla distribuzione e sulle attività del vettore e in generale dei reservoir animali) nonché ad una maggiore consapevolezza del problema e ad un’aumentata capacità diagnostica (2).
Molto limitati sono i dati sulla prevalenza generale delle infezioni da TBEV in Italia (3): in un recente studio italiano che ha valutato la presenza di anticorpi neutralizzanti anti-TBEV in province non endemiche (1573 volontari afferenti a centri ospedalieri di di Torino, Milano e Padova) si è osservata una prevalenza meritevole di approfondimento, pari allo 0,13 % (4).
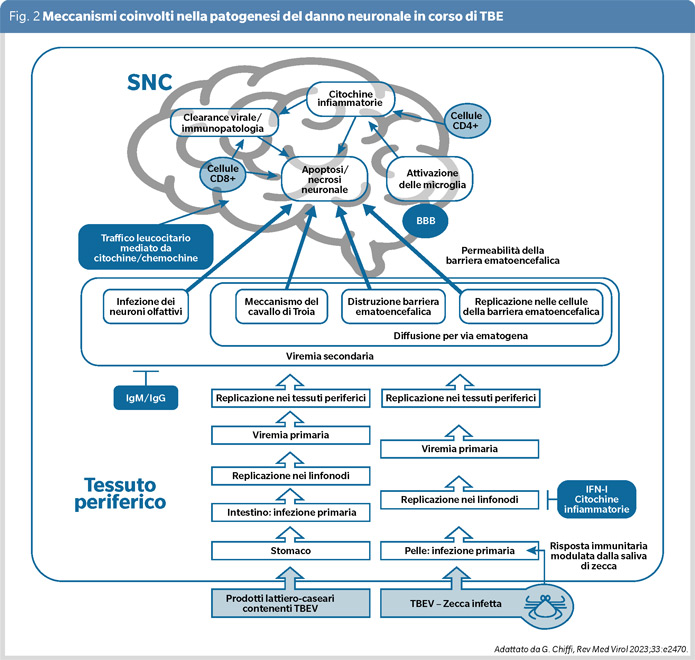
Il sottotipo europeo di TBEV è associato ad un interessamento del SNC nel 20-30% casi con tassi di mortalità pari allo 0,5-2% ; il sottotipo estremo-oriente è associato a una malattia più severa, spesso monofasica, con una letalità del 35%, il sottotipo siberiano è associato a una malattia meno severa con una letalità dell’1-3% ma con una tendenza a decorsi molto prolungati. La severità del coinvolgimento del SNC, caratteristica della seconda fase dell’infezione da TBEV, è espressione diretta dell’efficienza del processo di neuroinvasione, dall’entità del danno del SNC con lisi cellulare, necrosi e apoptosi dei neuroni infettati e dall’entità della risposta T - citossica nei confronti del patogeno (Figura 2).
Nei bambini l’interessamento neurologico è spesso limitato a quadri di meningite, mentre nei soggetti anziani e con comorbidità il rischio di sviluppare encefalite e encefalomielite è più elevato. La forma più severa di TBE è la meningo-encefalomielite caratteristicamente associata ad una paralisi flaccida più frequente a livello dei segmenti prossimali delle estremità superiori e a volte preceduta da dolore intenso dei gruppi muscolari coinvolti. Per tutte queste ragioni una proporzione relativamente alta di pazienti ha necessità di un ricovero in terapia intensiva. Il 40-50% dei pazienti affetti da TBE acuta sviluppa inoltre una sindrome post-encefalitica (PES) caratterizzata prevalentemente da disturbi neurocognitivi.
Un recente studio internazionale europeo condotto negli anni 2010-2017 ha confermato la severità e il profondo impatto sulla qualità della vita di questa patologia: nei 555 pazienti valutati il quadro clinico era caratterizzato da meningite, meningoencefalite, meningomielite e meningoencefalomielite rispettivamente nel 37%, 49%, 2,7% e 10,5% dei casi. L’età variava dagli 11 mesi agli 88 anni (mediana 50) e nel 25% dei pazienti era presente una comorbidità, più frequentemente una malattia cardiovascolare. Il 10% dei pazienti si è presentato con una paresi delle estremità, più frequentemente flaccida; una paralisi dei nervi cranici si è presentata nel 4,5 % di casi. Solo cinque (0,9%) pazienti sono deceduti durante l’ospedalizzazione, ma il 60% dei soggetti è stato dimesso con un recupero neurologico incompleto e nel 27% dei pazienti dimessi non era prevedibile un ulteriore recupero clinico (6). È particolarmente importante includere l’ipotesi di TBE nella diagnostica differenziale delle meningoencefaliti nei soggetti immunocompromessi. è stata infatti descritta la trasmissione di TBEV con il trapianto di organo solido: tre pazienti hanno ricevuto trapianto di organo solido (2 reni, 1 fegato) e hanno sviluppato 17-49 giorni dopo il trapianto un’encefalite severa, in un caso fatale: la presenza di TBEV mediante RT-PCR è stata documentata nei tre riceventi e nel donatore, aprendo il dibattito sulla opportunità o meno di screenare per TBEV i donatori residenti in aree o di ritorno da aree endemiche (7). Un report più recente ha inoltre documentato l’insorgenza di infezioni da arbovirus e, tra queste, di 3 encefaliti da TBEV in pazienti in terapia con rituximab, una delle quali fatale. La deplezione delle cellule B indotte dal trattamento con rituximab può incrementare infatti la neuroinvasività e la neurovirulenza del virus, l’incapacità a produrre anticorpi specifici anti-TBEV può essere associata a una viremia più elevata e l’assenza di una sintesi intratecale di anticorpi neutralizzanti può favorire uno shedding prolungato del virus all’interno del SNC, confermato dalla frequente possibilità di documentare mediante PCR TBEV-RNA nel liquor cerebrospinale. In pazienti in terapia con rituximab o altri farmaci anti CD20 le arbovirosi possono manifestarsi con un decorso atipico, severo e prolungato, spesso fatale e i test sierologici possono risultare poco utili nella diagnosi, da qui l’importanza di informare i pazienti sui rischi connessi alle punture di zecca e di raccomandare l’adozione di tutte le misure preventive (8).
Non vi è ad oggi una terapia specifica per la TBE, ma disponiamo di un vaccino inattivato, efficace in oltre il 95% dei casi. Il ciclo completo di vaccinazione primaria prevede la somministrazione intramuscolare di tre dosi, la seconda dose viene somministrata a distanza di 1-3 mesi dalla prima dose, ma può essere somministrata 2 settimane dopo se necessaria una protezione urgente. Le prime due dosi offrono già una protezione efficace, ma limitata nel tempo. La terza dose deve essere somministrata entro 5-12 mesi dopo la seconda dose ed è raccomandato un richiamo ogni 3 anni nelle persone di età superiore ai 60 anni, ogni 5 anni nelle persone più giovani. La possibilità di sviluppare TBE dopo un ciclo vaccinale primario completo è rara: in un recente studio condotto in Svezia solo 53/1004 (5%) episodi di TBE sono insorti in pazienti che avevano ricevuto almeno 2 dosi di vaccino, in maggioranza in persone anziane e con precedenti comorbidità (9)
La vaccinazione è raccomandata per soggetti professionalmente esposti, in particolare lavoratori in aree endemiche e in zone rurali e boschive (10) ma la copertura vaccinale è largamente inferiore alle attese.
È necessario aumentare in generale la consapevolezza dell’aumentato rischio di TBE e sottolineare che anche di fronte a questa malattia l’anamnesi è metà diagnosi: considerare la diagnosi di TBE in coloro che presentano febbre in associazione a una sintomatologia neurologica e vivono o sono di ritorno in aree dove TBE è endemica e indagare la presenza di una puntura di zecca o la possibile esposizione alla puntura di zecca sono elementi irrinunciabili di un corretto percorso diagnostico.
- Istituto Superiore di Sanità. EpiCentro - L'epidemiologia per la sanità pubblica https://www.epicentro.iss.it/
- Kahl O, Gray JS. The biology of Ixodes ricinus with emphasis on its ecology.Ticks Tick Borne Dis. 2023;14:102114.
- Cocchio S, Bertoncello C, Napoletano G, et al. Do We Know the true Burden of Tick-Borne Encephalitis? A cross-Sectional study. Neuroepidemiology. 2020;54:227-234.
- Castagna A, Schiavon S, Mengozzi G, et al. Tick-borne encephalitis seroprevalence in Northern Italy: a cross-sectional study on a randomly selected population, ECCMID 2024. Abstract 01654.
- Chiffi G, Grandgirard D, Leib SL, et al. Tick-borne encephalitis: A. comprehensive review of the epidemiology, virology and clinical picture. Rev Med Virol. 2023;33:e2470.
- Kohlmaier B, Schweintzger NA, Sagmeister MG, et al. Clinical Characteristics of Patients with Tick-Borne Encephalitis (TBE): A European Multicentre Study from 2010 to 2017. Microorganims. 2021;9:1420.
- Steininger PA, Bobinger T, Dietrich W, et al. Two cases of severe Tick-borne encephalitis in Rituximab-treated Patients in Germany: implications for diagnosis and prevention. Open Forum Infect Dis. 2017;4:ofx204.
- Lipowski D, Popiel M, PerleJewski K, et al. A Cluster of Fatal Tick-borne Encephalitis Virus Infection in Organ Transplant Setting. J Infect Dis. 2017;215:896-901.
- Hansson KE, Rosdahl A, Insulander M, et al. Tick-borne Encephalitis vaccine Failures: a 10-year retrospective study supporting the rational for adding an Extrapriming Dose in individual starting at age 50 years. Clin Infect Dis. 2020;70:245-51.
- Piano nazionale di prevenzione vaccinale (PNPV) 2023-2025, G.U. Serie Generale, n. 194 del 21 agosto 2023).






