La candidiasi invasiva intra-addominale (CIA) rappresenta tutt’oggi una sfida, in quanto fra le candidiasi invasive resta la più difficile da diagnosticare e, nonostante lo sviluppo di nuovi farmaci più efficaci e meno tossici, rimane gravata da una elevatissima mortalità.
Candida è definibile come un temporaneo o permanente abitante della flora endogena intestinale, la cui crescita è in equilibrio fra gli altri batteri colonizzanti ed il sistema immunitario dell’ospite. Tuttavia, quando la microflora intestinale viene alterata da insulti esterni (chirurgia addominale, terapie antibiotiche, immunodepressione), il microorganismo può invadere la cavità addominale.
Fattori di rischio
Nonostante negli anni siano stati identificati vari fattori di rischio per lo sviluppo di CIA, la prevalenza negli studi disponibili rimane piuttosto eterogenea, anche in popolazioni altamente selezionate. Tuttavia, si stima che un 30-40% dei pazienti affetti da peritonite secondaria o terziaria possa sviluppare una CIA, con una mortalità che si attesta intorno al 25-60% (1).
Fra i pazienti con infezioni intra-addominali, il riscontro di Candida da materiale intraperitoneale è considerato come un fattore di rischio indipendente per evoluzione sfavorevole. Al fine di tentare di abbattere questa elevatissima mortalità, la corretta gestione della CIA ne prevede il rapido riconoscimento, il controllo – spesso chirurgico – del sito di infezione, ed infine una pronta introduzione di una terapia antifungina attiva in vitro (2).
Sebbene non siano stati identificati specifici fattori predittivi di mortalità, la prognosi del paziente con CIA può essere influenzata dall’estensione dell’infezione, dall’origine dell’infezione non appendicolare e, relativamente all’ospite, dallo stato di immunosoppressione, l’età ed altre comorbidità.
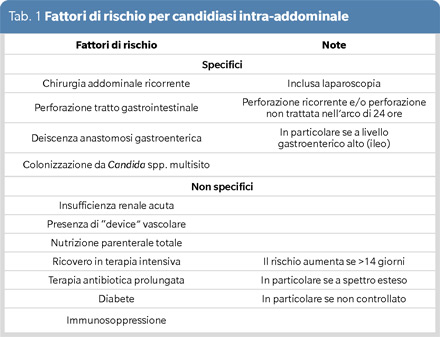 Generalmente, il paziente ad alto rischio per CIA è quello con storia recente di interventi chirurgici maggiori, e con lungo ricovero in terapia intensiva. In modo più specifico, è il re-intervento chirurgico che aumenta il rischio di CIA, in particolare se reso necessario da una nuova perforazione intestinale. Allo stesso modo, la deiscenza di una recente anastomosi, in particolare se a livello del tratto intestinale alto, è riconosciuto come fattore di rischio. Vi sono poi altri fattori già ritenuti significativi per le altre forme di candidiasi invasiva, quali la colonizzazione multi-sito, la presenza di cateteri vascolari centrali e l’esposizione prolungata a terapie antibiotiche ad ampio spettro (Tabella 1) (3).
Generalmente, il paziente ad alto rischio per CIA è quello con storia recente di interventi chirurgici maggiori, e con lungo ricovero in terapia intensiva. In modo più specifico, è il re-intervento chirurgico che aumenta il rischio di CIA, in particolare se reso necessario da una nuova perforazione intestinale. Allo stesso modo, la deiscenza di una recente anastomosi, in particolare se a livello del tratto intestinale alto, è riconosciuto come fattore di rischio. Vi sono poi altri fattori già ritenuti significativi per le altre forme di candidiasi invasiva, quali la colonizzazione multi-sito, la presenza di cateteri vascolari centrali e l’esposizione prolungata a terapie antibiotiche ad ampio spettro (Tabella 1) (3).
Dati di sorveglianza derivati da coorti europee confermano che, fra le specie responsabili, C. albicans è predominante (65-80%), anche se studi più recenti suggeriscono un progressivo shift verso specie non-albicans. In generale, il 92% delle CIA è determinato da 5 specie: C. albicans, C. glabrata, C. tropicalis, C. parapsilosis e C. krusei (4). A questo proposito, uno dei punti cruciali su cui ruota la gestione e l’evoluzione clinica delle CIA risiede nella diagnosi microbiologica.
Storicamente, la microbiologia standard ha una bassa performance verso Candida spp., in particolare da materiale intra-addominale, ove la sensibilità non va oltre al 60-70%. Ciò è anche determinato dal fatto che la concomitante candidemia è un evento molto raro: uno studio recente condotto in pazienti con CIA ne ha dimostrato un’incidenza intorno al 7% (5). Inoltre, il ruolo patogeno di Candida spp. nel contesto di una peritonite polimicrobica resta non del tutto definito (6).
Limiti dei metodi colturali
L’eventuale ritardo nell’instaurare il trattamento antifungino legato a questa scarsa affidabilità dei metodi colturali standard insieme ad un inevitabile protrarsi del tempo necessario per l’isolamento tramite esame colturale sono in parte causa dell’elevata mortalità in questo particolare setting. Per questo motivo negli ultimi anni generalmente si adotta un approccio pre-emptive ovvero l’introduzione di un antifungino in presenza di segni/sintomi di infezione in pazienti con fattori di rischio. Il problema, che è stato lampante già dai primi studi comparativi su questa strategia, risiede nel fatto che l’incidenza di CIA, anche in popolazioni selezionate, non sembrerebbe così alta da giustificare un approccio pre-emptive universale. Per tali motivi sono stati implementati nuovi marker, diretti od indiretti, in grado di avere alta accuratezza e rapidità di refertazione. Molti autori hanno proposto la determinazione sierica del (1-3) Beta-D-Glucano (BDG), componente della parete cellulare di Candida spp., come marcatore indiretto di infezione. Tale indagine ha alcuni punti di forza, fra cui la rapidità di refertazione ed un elevatissimo valore predittivo negativo.
Inizialmente, diversi studi hanno utilizzato un approccio BDG-guidato (in alcuni casi anche almeno due valori positivi) per introdurre o confermare una terapia empirica antifungina. Tuttavia, tale indagine risente di falsi positivi, dovuti a concomitante utilizzo di emodialisi, albumina o altre condizioni. Inoltre, la soluzione di continuo intestinale è già di per sé una causa di BDG - falsamente - positivo.
Recenti studi, fra cui un trial randomizzato, hanno dimostrato come sfruttare l’alto valore predittivo negativo per sospendere una eventuale terapia antifungina empirica. Con tale approccio si è dimostrata una netta riduzione della prescrizione di antifungini, idealmente non necessari, senza un impatto significativo sulla mortalità. È da notare tuttavia che alcuni ceppi di Candida spp., tra cui C. glabrata, sono associati a valori di BDG sierici pressoché negativi. In questo contesto, l’utilizzo della biologia molecolare (il cosiddetto T2 Candida panel), potrebbe determinare una vera rivoluzione nella diagnostica di una patologia così difficile considerando l’elevatissima sensibilità e rapido turnover.
Anche la singola scelta della molecola antifungina merita una riflessione. Il tessuto intra-addominale può, per certi versi, essere definito come un santuario, ovvero un sito in cui è difficile assicurare concentrazioni di farmaco sufficienti.
Approccio terapeutico
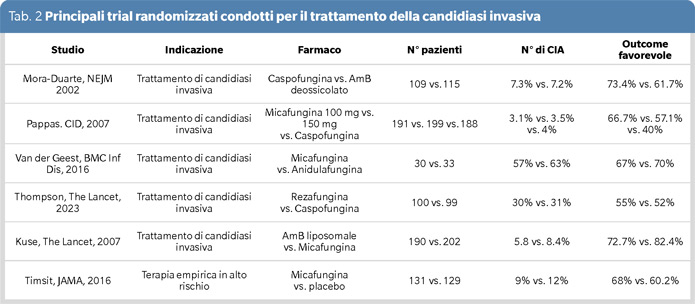
Al fine di ottimizzare l’efficacia antimicrobica e, dall’altro lato, di ridurre il rischio di resistenze è necessario utilizzare molecole che posseggano una cinetica favorevole per il sito di infezione. Nonostante non esistano trial randomizzati specificamente orientati verso il trattamento della CIA, alcuni dati ci vengono forniti indirettamente da studi focalizzati sul trattamento della candidiasi invasiva in generale. In questi studi non è mai stata dimostrata una superiorità di una molecola sull’altra (Tabella 2).
Gli azoli (in particolare fluconazolo) garantiscono una penetrazione sufficiente in addome, ma vari studi hanno dimostrato una maggiore percentuale di fallimento terapeutico se comparati con farmaci con attività fungicida (7). Inoltre è ampiamente dimostrato un progressivo incremento di resistenza a fluconazolo sia nei ceppi albicans che non-albicans, rendendo l’utilizzo di questo farmaco quantomeno rischioso, in particolare nel paziente critico. Le echinocandine sono i farmaci di prima scelta in questo specifico setting, ma sta emergendo l’evidenza che la penetrazione intra-addominale potrebbe essere subottimale, potenzialmente favorendo l’insorgenza di resistenze. Essendo altamente legate all’albumina plasmatica, solo una piccola frazione libera è in grado di raggiungere lo spazio extravascolare. Sono inoltre influenzate dal peso corporeo. Tutti questi elementi hanno portato alcuni autori a suggerire dosaggi maggiori per il trattamento della CIA (8).
Amphotericina B liposomiale (L-AmB), significativamente meno nefrotossica rispetto alle precedenti formulazioni, può essere un’ottima alternativa, anche se sicuramente meno maneggevole rispetto alle echinocandine, che sono generalmente ben tollerate. L-AmB è caratterizzata da attività fungicida concentrazione dipendente, estremamente legata al picco plasmatico raggiunto. Una recente revisione sistematica della letteratura ha concluso che il farmaco possiede attività fungicida anche in siti difficili da raggiungere, quali il peritoneo (9). Il dosaggio generalmente consigliato per il trattamento della CIA è 3 mg/Kg al giorno. Considerando la peculiare cinetica del farmaco, con un’azione strettamente legata al picco plasmatico raggiunto, alcuni autori hanno ipotizzato una prima dose a 5 mg/Kg, garantendo in questo modo una copertura sufficiente per almeno 3 giorni, per poi riprendere un dosaggio standard qualora il risultato del BDG basale fosse positivo (10).
- Montravers P, Dupont H, Gauzit R, et al. Candida as a risk factor for mortality in peritonitis. Crit Care Med [Internet]. 2006;34(3):646-52.
- Ostrosky-Zeichner L, Pappas PG. Invasive candidiasis in the intensive care unit. Crit Care Med. 2006;34(3):857-63.
- Bassetti M, Marchetti M, Chakrabarti A, et al. A research agenda on the management of intra-abdominal candidiasis: results from a consensus of multinational experts. Intensive Care Med. 2013;39(12):2092-106.
- Bassetti M, Righi E, Ansaldi F, et al. A multicenter multinational study of abdominal candidiasis: epidemiology, outcomes and predictors of mortality. Intensive Care Med. 2015;41(9):1601-10.
- Bassetti M, Vena A, Giacobbe DR, et al. Risk Factors for Intra-Abdominal Candidiasis in Intensive Care Units: Results from EUCANDICU Study. Infect Dis Ther. 2022;11(2):827-40.
- Clancy CJ, Nguyen MH. Finding the ‘missing 50%’ of invasive candidiasis: how nonculture diagnostics will improve understanding of disease spectrum and transform patient care. Clin Infect Dis Off Publ Infect Dis Soc Am. 2013;56(9):1284-92.
- Gafter-Gvili A, Vidal L, Goldberg E, et al. Treatment of invasive candidal infections: systematic review and meta-analysis. Mayo Clin Proc. 2008;83(9):1011-21.
- Liu X, Liu D, Pan Y, Li Y. Pharmacokinetic/pharmacodynamics variability of echinocandins in critically ill patients: A systematic review and meta-analysis. J Clin Pharm Ther. 2020;45(6):1207-17.
- Keane S, Geoghegan P, Povoa P, et al. Systematic review on the first line treatment of amphotericin B in critically ill adults with candidemia or invasive candidiasis. Expert Rev Anti Infect Ther. 2018;16(11):839-47.
- Rinaldi M, Bartoletti M, Bonazzetti C, et al. Tolerability of pulsed high-dose L-AmB as pre-emptive therapy in patients at high risk for intra-abdominal candidiasis: A phase 2 study (LAMBDA study). Int J Antimicrob Agents. 2023;62(6):106998.






