Nonostante la soppressione virologica efficace di HIV nel plasma con la terapia antiretrovirale (ART), le persone con infezione da HIV (PWH) possono sperimentare compromissione neurocognitiva. I criteri frequentemente utilizzati sono i criteri HAND (HIV-associated neuro-cognitive disorders) del 2007 (1). Tuttavia, l'incidenza stimata del 20-97% non corrisponde alle osservazioni cliniche più recenti, con un tasso di falsi positivi del 26% (2). La condizione di ANI (asymptomatic neurocognitive impairment) è discussa, ma la sua rilevanza clinica è incerta, e molte linee guida non raccomandano lo screening.
La classificazione del deterioramento cognitivo nelle PWH dovrebbe considerare una combinazione di sintomi, test e indagini neurologiche, ma fattori come comorbidità, istruzione e fattori socioeconomici possono influenzare l'interpretazione dei risultati (3). Un nuovo approccio proposto riconosce la natura multifattoriale di HAND, con una rappresentazione più fedele della patogenesi di HIV sul sistema nervoso centrale (SNC).
La patologia cerebrale da HIV e le comorbidità dovrebbero essere specificate ove possibile, come ad esempio, malattie psichiatriche, neurotossicità da ART, carenze nutrizionali e vitaminiche, condizioni neurodegenerative, malattie cerebrovascolari, traumi cranici, precedenti infezioni del SNC, traumi alla nascita e fattori legati allo stile di vita come l'alcolismo e l'abuso di sostanze, infezioni intercorrenti. Un modello di patogenesi della compromissione della funzione cognitiva è riportato in figura 1.
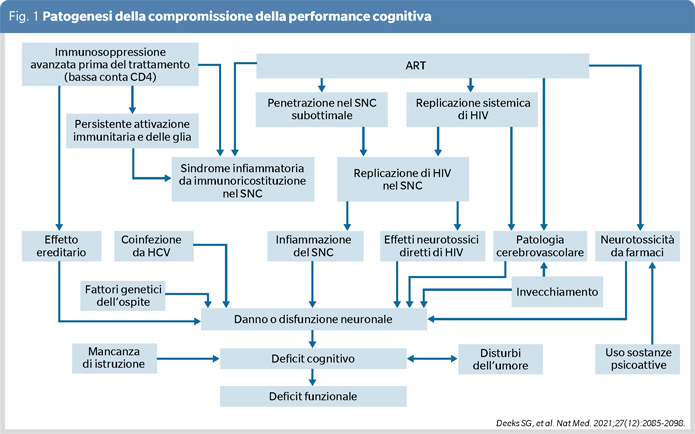
Secondo i più ampi studi di coorte, alcuni marcatori infiammatori sembrano essere associati a mortalità per qualsiasi causa ed in particolare a patologia cardiovascolare, tra cui IL-6 e fattore solubile CD14.
La presenza di sindrome metabolica e di patologia cardiovascolare sono fattori associati all’impairment neurocognitivo (4-6). Coorti come POPPY (Pharmacokinetic and Clinical Observation in People over fifty) e COBRA (The ComorBidity in Relation to Aids) esaminano associazioni tra profili infiammatori, qualità del sonno, salute mentale e disordini neurocognitivi in PWH e gruppi di controllo (7,8). Non si osserva un’associazione significativa tra i profili infiammatori e qualità del sonno, a differenza di quanto riscontrato per sintomi depressivi e funzione cognitiva (associazione con sCD14, sCD163 plasmatici, neopterina e K/T ratio nel SNC).
Resta controverso se la ART che si distribuisce meglio nel SNC sia cruciale per trattare la condizione di HAND. Lo studio A5324 randomizzato, placebo, controllato, ha valutato l'efficacia, nell'arco di 96 settimane, dell'aggiunta di 2 farmaci ben tollerati, dolutegravir (DTG) e maraviroc (MVC), al regime ART soppressivo di PWH con HAND, i cui risultati non hanno supportato l'intensificazione empirica dell'ART come trattamento per HAND (9).
Reservoir del SNC e strategia di cura
Le cellule infettate in modo latente da HIV sono principalmente silenti a livello trascrizionale, ma contengono un virus in grado di replicare dopo l’interruzione della ART.
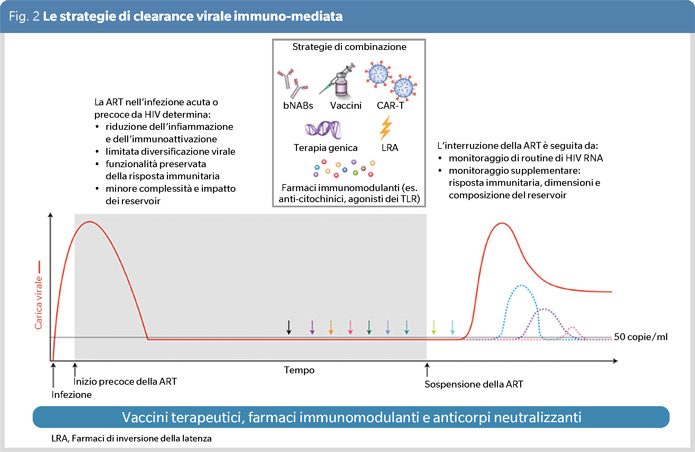
Le strategie di clearance virale immuno-mediata delle cellule latenti includono approcci combinati (immunomodulanti, anticorpi neutralizzanti e vaccini terapeutici) (Figura 2), durante la fase soppressiva della ART o durante la fase di interruzione del trattamento, per ritardare il rebound virale o ridurre il set point della replicazione virale a un livello di <200 copie/ml.
Il sistema nervoso centrale (SNC) è considerato un sito di persistenza di HIV. Le cellule T infette (virus T-tropico) e le cellule mieloidi (macrofagi M-tropico e microglia) nel SNC possono fungere da serbatoi stabili. Studi sul liquor di PWH in ART mostrano la presenza di virus M-Tropico, T-Tropico e bassa carica di DNA virale nel SNC. L'analisi del liquor correla la compartimentalizzazione virale con biomarcatori infiammatori quali neopterina e neurofilamento, e l'associazione di virus M-tropico con cariche virali elevate (10). HIV persiste nella microglia con caratteristiche distinte, sensibili ai modulatori epigenetici.
Tra le proteine identificate in proteomica in relazione alla presenza di HAND, è emerso un ruolo significativo di IFN-I, in quanto la persistenza dell'RNA di HIV nel SNC può mantenere un'attivazione persistente del segnale IFN-I e l'attivazione irrisolta e persistente dell'IFN-I nel SNC può portare alla neuroinfiammazione correlata alla HAND anche sotto ART. Infine l’attivazione persistente di IFN-I può verificarsi sia nei compartimenti periferici che nel SNC (11).
La presentazione tardiva di HIV e le coinfezioni possono influenzare l'infiammazione e i serbatoi di HIV, dimostrando che il recupero immunitario, la stimolazione e il traffico di cellule CD4+T specifiche determinano persistenza virale, con la graduale sostituzione dei reservoir di HIV con provirus resistenti alla ART in condizioni di IRIS-PML, ad esempio. Anche la meningite criptococcica pre-ART facilita la compartimentalizzazione nel liquor [Manion, Lange et al., Unpublished data].
Nuovi trattamenti per HIV e il SNC
Nonostante i regimi semplificati, l'aderenza al trattamento antiretrovirale (ART) può essere subottimale, aumentando il rischio di fallimento virologico e resistenza. Le molecole a lunga durata d'azione (LA) offrono un'opzione conveniente per evitare la somministrazione orale quotidiana e mitigare l'impatto della mancata aderenza sulla resistenza virale.
La persistenza della replicazione di HIV nei reservoir virali, compreso il sistema nervoso centrale (SNC), può contribuire all'infiammazione associata alla compromissione neurocognitiva.
L'ART è efficace nel ridurre l'HIV-1 RNA a livelli non rilevabili nel plasma, ma il virus può essere ancora presente nel liquor, in particolare quando la penetrazione antiretrovirale nel liquor porta a livelli inferiori alle concentrazioni terapeutiche efficaci.
Alcuni sottostudi di LATTE-2, ATLAS e ATLAS2M (12) hanno valutato le concentrazioni plasmatiche e liquorali di partecipanti sottoposti a terapia LA con cabotegravir e rilpivirina ogni 4 o 8 settimane a dosaggi adeguati, dimostrando che questa combinazione di terapia duplice raggiunge concentrazioni terapeutiche nel liquor e in assenza di modifiche dei marcatori infiammatori liquorali o di danno neurologico.
Prospettive terapeutiche future includono l’utilizzo di lenacapavir, islatravir di cui al momento non vi sono dati sulle distribuzioni tissutali e gli anticorpi monoclonali, la cui penetrazione nel SNC è ostacolata dalle dimensioni e dalla barriera emato-liquorale.
Lo studio MARANDX ha esaminato lo switch a regimi meno neurotossici come MVC, FTC e DRV/c, evidenziando miglioramenti cognitivi (Digit Span backward test e immediate recall) e modifiche significative nei biomarcatori infiammatori e di danno neurologico, tra cui aumento di neopterina e riduzione della proteina tau fosforilata.
L'uso di INSTI, in particolare la combinazione DTG+3TC, è associato a efficacia e sicurezza nella popolazione neurocognitivamente compromessa (13).
Doravirina ha dimostrato un miglioramento degli eventi neuropsichiatrici a 192 settimane di osservazione post switch da regimi contenenti EFV, mantenendo comunque una quota di disturbi quali insonnia, depressione e cefalea.
Altre potrebbero avere un ruolo nella neuroprotezione come, ad esempio, il meccanismo d’azione di fostemsavir che, inibendo la gp120 di HIV, interferisce con il legame con i CD4, quindi con potenziale conseguente riduzione dei biomarcatori infiammatori, oppure lenacapavir che con l’inibizione del capside e della successiva integrazione virale potrebbe portare a più virus difettivo. Infine, la terapia con bNAb (Broadly neutralizing HIV-1 antibodies) durante l'interruzione della ART è associata al potenziamento della risposta T -CD4, ma se queste risposte possano contribuire al controllo virale nel SNC rimane ancora da determinare.
NEUROCOVID – Meccanismi e biomarcatori di patologia
 Le complicanze neurologiche relate all’infezione da SARS-CoV-2 possono essere acute e le manifestazioni neuropsicologiche di Long COVID (Figura 3). Nella fase acuta, le complicanze sono ascrivibili a meccanismi come l'infiammazione sistemica, l'endotelite cerebrale, la trombosi microvascolare, l'ipercoagulabilità e l'ipossia. Nonostante segnalazioni aneddotiche di presenza di SARS-CoV-2 nel SNC, la neuroinvasione virale non sembra essere un dato condiviso. Uno studio svedese, su adulti con infezione da COVID-19 e sintomi neurologici, ha dimostrato una correlazione tra la presenza di antigene S virale nel liquor e l’attivazione immunitaria del SNC, suggerendo che i componenti virali possono influire sulle risposte immunitarie del SNC senza una neuroinvasione diretta (14).
Le complicanze neurologiche relate all’infezione da SARS-CoV-2 possono essere acute e le manifestazioni neuropsicologiche di Long COVID (Figura 3). Nella fase acuta, le complicanze sono ascrivibili a meccanismi come l'infiammazione sistemica, l'endotelite cerebrale, la trombosi microvascolare, l'ipercoagulabilità e l'ipossia. Nonostante segnalazioni aneddotiche di presenza di SARS-CoV-2 nel SNC, la neuroinvasione virale non sembra essere un dato condiviso. Uno studio svedese, su adulti con infezione da COVID-19 e sintomi neurologici, ha dimostrato una correlazione tra la presenza di antigene S virale nel liquor e l’attivazione immunitaria del SNC, suggerendo che i componenti virali possono influire sulle risposte immunitarie del SNC senza una neuroinvasione diretta (14).
Le manifestazioni neurologiche acute sono accompagnate da tipici reperti di neuroimmagine, come anomalie dei bulbi olfattivi, lesioni ischemiche e microemorragie cerebrali.
Per quanto riguarda Long COVID, la patogenesi delle manifestazioni neuropsicologiche è ancora poco conosciuta. Lo studio COVID Mind ha dimostrato la totale assenza di evidenza di incremento dei marcatori di danno di barriera nel liquor, dei livelli di citochine/chemochine e/o persistenza di antigeni virali nel plasma/liquor, ad eccezione di un incremento dei marcatori plasmatici di disfunzione vascolare (15).
Interessante il confronto tra le manifestazioni neurologiche di HIV e SARS-CoV-2, entrambi i virus inducono immunoattivazione e danno neuronale, ma con differenze nella circolazione di cellule immunitarie, danno cerebrovascolare e neuroinvasione.
- Antinori A, Arendt G, Becker JT, et al. Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-99.
- Gisslén M, Price RW, Nilsson S. The definition of HIV-associated neurocognitive disorders: are we overestimating the real prevalence? BMC Infect Dis. 2011;11:356.
- Heaton RK, Ellis RJ, Tang B, et al. Twelve-year neurocognitive decline in HIV is associated with comorbidities, not age: a CHARTER study. Brain. 2023;146(3):1121-1131.
- Wright EJ, Grund B, Robertson K, et al. Cardiovascular risk factors associated with lower baseline cognitive performance in HIV-positive persons. Neurology. 2010;75(10):864-73.
- McCutchan JA, Marquie-Beck JA, Fitzsimons CA, et al. Role of obesity, metabolic variables, and diabetes in HIV-associated neurocognitive disorder. Neurology. 2012;78(7):485-92.
- Valcour V, Rubin LH, Tien P, et al. Human immunodeficiency virus (HIV) modulates the associations between insulin resistance and cognition in the current combination antiretroviral therapy (cART) era: a study of the Women's Interagency HIV Study (WIHS). J Neurovirol. 2015;21(4):415-21.
- Bakewell N, Sabin CA, Negi R, et al. Biomarker associations with insomnia and secondary sleep outcomes in persons with and without HIV in the POPPY-Sleep substudy: a cohort study. Sleep. 2022;45(12): zsac212.
- van Zoest RA, Underwood J, De Francesco D, et al. Structural Brain Abnormalities in Successfully Treated HIV Infection: Associations With Disease and Cerebrospinal Fluid Biomarkers. J Infect Dis. 2017;217(1):69-81.
- Letendre SL, Chen H, McKhann A, et al. Antiretroviral Therapy Intensification for Neurocognitive Impairment in Human Immunodeficiency Virus. Clin Infect Dis. 2023;77(6):866-874.
- Joseph SB, Kincer LP, Bowman NM, et al. Human Immunodeficiency Virus Type 1 RNA Detected in the Central Nervous System (CNS) After Years of Suppressive Antiretroviral Therapy Can Originate from a Replicating CNS Reservoir or Clonally Expanded Cells. Clin Infect Dis. 2019;69(8):1345-1352.
- Tang Y, Chaillon A, Gianella S, et al. Brain microglia serve as a persistent HIV reservoir despite durable antiretroviral therapy. J Clin Invest. 2023;133(12):e167417.
- Letendre SL, Mills A, Hagins D, et al. Pharmacokinetics and antiviral activity of cabotegravir and rilpivirine in cerebrospinal fluid following long-acting injectable administration in HIV-infected adults. J Antimicrob Chemother. 2020;75(3):648-655.
- Trunfio M, Rugge W, Mighetto L, et al. Dual antiretroviral therapies are effective and safe regimens in the central nervous system of neurologically symptomatic people living with HIV. AIDS. 2020;34(13):1899-1906.
- Edén A, Grahn A, Bremell D, et al. Viral Antigen and Inflammatory Biomarkers in Cerebrospinal Fluid in Patients With COVID-19 Infection and Neurologic Symptoms Compared With Control Participants Without Infection or Neurologic Symptoms. JAMA Netw Open. 2022;5(5):e2213253.
- Farhadian SF, Reisert HD, McAlpine L, et al. Self-Reported Neuropsychiatric Post-COVID-19 Condition and CSF Markers of Neuroinflammation. JAMA Netw Open. 2023;6(11):e2342741.






