| |
|
|
| |
| HIV complications |
|
|
 |
| |
A conferma di questi cambiamenti epidemiologici, casi di morte vengono spesso osservati anche in persone con elevate conte dei CD4.
Dati analoghi sono emersi dalla coorte EuroSIDA, nella quale oltre il 50% dei decessi è risultato attribuibile a cause non AIDS (soprattutto infezioni, malattie epatiche e tumori). Da segnalare che non è emersa alcuna associazione tra mortalità e regime antiretrovirale (#790).
|
|
| Per quanto riguarda le complicazioni “classiche” (disturbi del metabolismo lipidico e malattie cardiovascolari), le comunicazioni al CROI 2011 non sono state numerose come nelle passate edizioni. Alcune, però, meritano attenzione. In primo luogo la conferma, in una popolazione di 235.000 pazienti (di cui 20.775 HIV-positivi) seguiti nell’ambito del Kaiser Network of Clinics in California, che l’infezione da HIV si associa a un aumento del 40% del rischio di infarto miocardico e del 20% di malattie cardiovascolari, con una proporzionalità diretta tra aumento del rischio e gravità dell’immunodeficienza (#810). |
|
| In secondo luogo la “riabilitazione” dell’abacavir, che i risultati di grandi studi come il D:A:D e lo SMART negli anni 2008-2009 avevano indicato come responsabile di un’aumentata incidenza di infarto miocardico. Una metanalisi effettuata dall’FDA unicamente su studi randomizzati (escludendo quindi quelli osservazionali) condotti tra il 1996 e il 2010 ha dimostrato infatti che su 9.832 pazienti, dei quali circa la metà trattati con abacavir, non si è evidenziata una associazione tra uso di questo farmaco e aumento del rischio di infarto (#808). |
|
| Terzo messaggio: per evitare che il “fumo di sigaretta” costituisse un fattore confondente nell’analisi statistica, Desvarieux et al. hanno studiato una popolazione di 100 HIV+ non fumatori, confrontandoli con 50 soggetti sieronegativi, omogenei per parametri demografici, e valutato i fattori clinici e immunovirologici associati all’aumento dello spessore dell’intima carotidea (cIMT), utilizzato come marcatore di aterosclerosi. Il parametro che maggiormente è risultato influenzare cIMT è risultato la durata dell’infezione da HIV, mentre nessuna associazione è emersa con il regime terapeutico (#803). Anche in questo caso sembra quindi che una protratta “convivenza” con il virus sia comunque dannosa e, di conseguenza, che un trattamento antiretrovirale precoce possa prevenire o rallentare la comparsa di complicazioni cardiovascolari. |
|
A parte questi risultati, il vero protagonista delle “HIV complications”, al CROI 2011, sembra essere stato l’osso, che appare coinvolto sia nell’ambito di una generale “fragilità” della persona sieropositiva, che interessa anche i soggetti di sesso maschile (#791) sia nel contesto di manifestazioni tipiche di osteopenia e osteoporosi.
La tossicità a carico del tessuto osseo rappresenta infatti un problema emergente, specialmente nei pazienti più anziani.
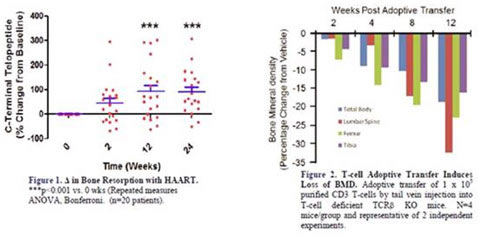
Risultati abbastanza inattesi sono stati riportati da Ofotokun: diversamente da altre patologie, la perdita di sostanza ossea non sembra essere una complicanza a lungo termine, ma un evento precoce, cronologicamente associato all’immunoricostituzione, in quanto può verificarsi nei primi 3 mesi di terapia, quando la riduzione della densità ossea, documentata con DEXA e TAC, può raggiungere valori paragonabili a quelli della menopausa. Successivamente, dopo circa 2 anni, si osserva una stabilizzazione. In circolo si riscontra un aumento di proteine legate alla degradazione del collagene e di RANK-L (Receptor Activator Nuclear factor Kb-Ligand).
L’ipotesi, confermata in uno studio eseguito sui topi dagli stessi autori, è che RANK-L, legandosi al suo recettore specifico (RANK) presente nei precursori e nelle forme immature degli osteoclasti, attivi una cascata di segnali che portano alla formazione di osteoclasti maturi.
Questi eventi sembrano legati all’immunoricostituzione, particolarmente vivace all’inizio della terapia antiretrovirale: i CD4 attivati rilasciano infatti TNF che, a sua volta, stimola la produzione di RANK-L ( #78). |
| |
 |
| |
Come meccanismo di compenso conseguente al riassorbimento osseo, dalla 24° settimana aumentano i livelli di osteocalcina (un marcatore di attività osteoblastica), fino al 300%. Lo studio nell’uomo e quello negli animali hanno fornito risultati sovrapponibili, a parte la riduzione dei valori di osteocalcina nei topi, a indicare una limitata capacità di compensazione da parte degli osteoblasti. Lo studio non è completato, in quanto alcune analisi sono in corso, in particolare l’eventuale correlazione tra alterazioni ossee e assunzione di tenofovir. Tuttavia, l’associazione tra perdita di densità ossea e immunoricostituzione è di grande interesse, sia patogenetico che pratico, in quanto suggerirebbe l’opportunità di iniziare precocemente trattamenti atti a limitare l’evoluzione del danno osseo. |
|
Se nello studio appena menzionato non è ancora chiaro l’eventuale ruolo del tenofovir, questo emerge invece abbastanza nettamente da altri lavori presentati al CROI, a partire da uno specifico sottostudio nell’ambito dell’iPrEx, il grande trial sull’utilità della chemioprofilassi con tenofovir/emtricitabina per la prevenzione della trasmissione dell’HIV, recentemente pubblicato sul NEJM. Il sottostudio in questione coinvolgeva 500 persone a rischio, metà trattate con farmaci attivi e metà con placebo e ha dimostrato, dopo 24 e 48 settimane, una significativa riduzione della massa ossea, documentata con DEXA, nel gruppo trattato. Nell’interpretazione di questi risultati vanno considerati sia il limitato periodo di follow up, sia il fatto che l’intera popolazione, al baseline, presentava un grado di osteopenia maggiore che nella popolazione generale: 33% di soggetti con Z.score inferiore a -1, rispetto al 16% atteso (#94LB).
Risultati simili sono stati osservati in un altro trial di PrEP con tenofovir condotto in 400 omosessuali maschi di San Francisco, nei quali dopo 2 anni è stata misurata una perdita di densità ossea di circa il 2%. Anche in questo caso i valori di densità ossea, all’ingresso, erano inferiori a quelli della popolazione generale; una subanalisi ha evidenziato dati diversi a seconda dello stile di vita: chi faceva uso di amfetamine e poppers appariva a maggior rischio di ridotta densità ossea, mentre il contrario si rilevava in chi assumeva regolarmente vitamina D e calcio (#93). |
|
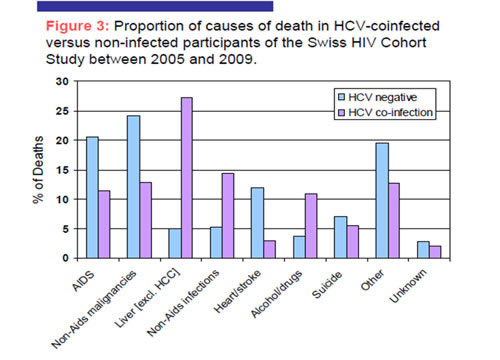
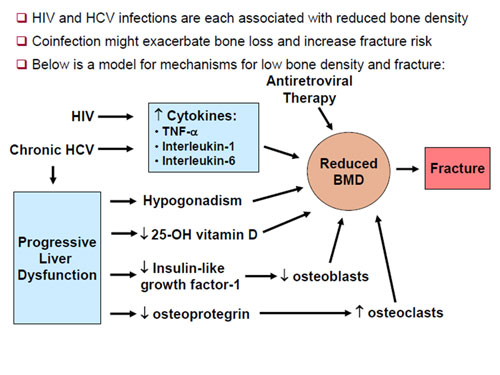
La coinfezione HIV-HCV è un’altra causa di aumentato rischio di demineralizzazione ossea e incidenza di fratture, come dimostrato da un’analisi condotta su grandi numeri di soggetti coinfetti (37.000 circa), infetti dal solo HIV (95.000) o dal solo HCV (277.000) in vari stati nordamericani (#914).
I risultati di questo studio hanno, infatti, dimostrato che i soggetti coinfetti, soprattutto se di sesso femminile, sono esposti a un maggior rischio di fratture femorali rispetto a quelli monoinfetti con HCV, e di fratture sia a carico del femore che della colonna vertebrale rispetto a quelli mono- o non infetti. E’ chiaro che in questo caso la patogenesi del danno osseo riconosce meccanismi diversi, che comprendono sia i virus che le terapie. |
| |
 |
| |
| La tossicità ossea appare, quindi, un fenomeno che interessa tutte le persone HIV+, inclusi bambini e adolescenti (#706), e che riconosce concause varie, dagli effetti diretti dell’infezione a quelli dei farmaci antiretrovirali (tenofovir, in particolare), agli stili di vita e alle coinfezioni. Queste considerazioni sottolineano l’importanza di sottoporre precocemente i pazienti, indipendentemente da sesso e età, a procedure di screening della densità ossea e, eventualmente, a terapie appropriate. Un punto interrogativo sul GS-7340, il profarmaco del tenofovir dotato di una maggiore potenza e capacità di penetrazione nei PBMC (#152LB). Non è chiaro se una maggiore penetrazione negli osteoblasti possa tradursi anche in un aumento della tossicità ossea. |
|
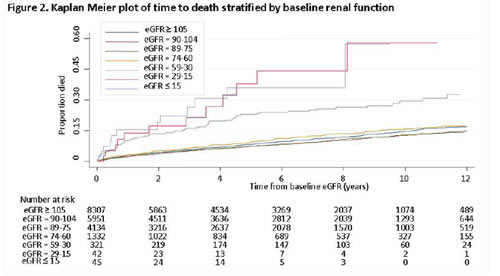
| Altra importante complicanza d’organo è la nefropatia in corso di infezione da HIV, che nella coorte inglese CHIC si conferma strettamente associata alla mortalità (#836). |
| |
 |
| |
| La razza nera emerge come fattore di rischio, sia nella stessa coorte CHIC che in un sottostudio dello SMART (Strategies for Management of Antiretroviral Therapy), nel quale i pazienti randomizzati a una terapia intermittente con interruzioni CD4-guidate sono risultati a maggior rischio di declino della funzionalità renale. La riduzione del GFR anche in questo caso era significativamente associata a un aumento della mortalità (#837). |
|
| Come per le complicazioni a carico del tessuto osseo, anche per la nefrotossicità la coinfezione HIV-HCV rappresenta un fattore di rischio, essendo associata a un più rapido declino del GFR (#929). |
|
Per quanto riguarda l’eventuale responsabilità del tenofovir, i dati non sono molto chiari. Si tratta di un tema ampiamente dibattuto, anche in considerazione della crescente diffusione di questo farmaco nei paesi a risorse limitate, nei quali il monitoraggio della funzione renale può essere complicato. Dati incerti sullo screening dei pazienti a rischio di nefrotossicità, sono emersi da studi condotti in Malawi (#838)
e in Sudafrica (#840).
L’argomento è controverso anche nei paesi con maggiori risorse, e uno dei motivi è la disomogeneità dei criteri adottati per la definizione di insufficienza renale nei vari studi.
Di interesse il rapporto tra livelli plasmatici di tenofovir e nefrotossicità: in uno studio condotto su 163 pazienti è emersa una correlazione significativa tra elevate concentrazioni di tenofovir nel plasma (Ctrough > 90 ng/ml) e declino della funzionalità renale. L’alta percentuale di soggetti con Ctrough > 90 ng/ml (51%) sottolinea l’importanza del TDM per decidere eventuali riduzioni del dosaggio (#842).
In generale, per ottenere dati conclusivi sulla nefrotossicità nelle persone HIV+ non solo sono necessari ulteriori studi; occorre, in primo luogo, una standardizzazione del metodo per valutare il grado di compromissione renale e calcolare la velocità di filtrazione glomerulare (GFR): formula di Cockroft e Gault, MRDR, MRDR semplificata. |
|
|
|
|
|
|