Introduzione
Negli ultimi quindici anni, le infezioni gravi da batteri Gram-negativi resistenti ai carbapenemi (carbapenem-resistant Gram-negative bacteria, CR-GNB) hanno rappresentato un’importante sfida per il medico, alla luce delle ridotte opzioni terapeutiche attive disponibili. Inoltre, pur considerando il loro valore in termine di tassi di cura, farmaci come polimixine, aminoglicosidi o glicilcicline possono presentare alcuni svantaggi come la possibile nefrotossicità e/o la farmacocinetica subottimale in alcuni siti di infezione (per esempio, la ridotta penetrazione polmonare) (1).
Recentemente, si è iniziato ad osservare un cruciale cambiamento nell’approccio alla terapia sia empirico-ragionata che mirata delle infezioni gravi da CR-GNB, dovuto alla disponibilità di nuovi antibiotici beta-lattamici o di nuovi inibitori delle beta-lattamasi in associazione con beta-lattamici classici, attivi nei confronti di CR-GNB. In particolare, in questo articolo discuteremo brevemente le caratteristiche e la posizione di cefiderocol, una nuova cefalosporina siderofora, negli algoritmi terapeutici delle infezioni gravi da CR-GNB.
Caratteristiche della molecola e attività antimicrobica in vitro
L’attività di cefiderocol nei confronti di CR-GNB è in parte dovuta al suo assorbimento attraverso la membrana esterna batterica anche mediante trasportatori di ferro, evitando alcuni meccanismi di resistenza ai beta-lattamici mediati da pompe di efflusso e/o alterazioni delle porine. Inoltre, cefiderocol ha dimostrato notevole stabilità in vitro in presenza di beta-lattamasi, comprese le carbapenemasi di classe A (es. KPC), B (es. IMP, VIM, NDM) e D (es. OXA) (2).
In aggiunta, similarmente a cefepime, cefiderocol è un debole induttore di AmpC, una caratteristica che può rendere conto della sua buona attività anche in caso di iperproduzione di AmpC.
Nel corso degli anni, ampi studi di sorveglianza della suscettibilità a cefiderocol hanno evidenziato un’estesa attività in vitro nei confronti di batteri appartenenti all’ordine degli Enterobacterales. In particolare, nei confronti di Enterobacterales resistenti ai carbapenemi vi era inibizione della crescita del 97% degli stessi a concentrazioni di cefiderocol pari a 4 mg/L. Per quanto riguarda i GNB non fermentanti, un’inibizione di più del 98% dei ceppi di Pseudomonas aeruginosa resistente ai carbapenemi, compresi ceppi produttori di metallo-beta-lattamasi, è stata osservata per concentrazioni di cefiderocol pari a 2 mg/L, e una valida attività è stata osservata anche nei confronti di ceppi di Acinetobacter baumannii produttori di carbapenemasi di tipo OXA (MIC90 pari a 1 mg/L).
Farmacocinetica e farmacodinamica
Cefiderocol dimostra un comportamento farmacocinetico lineare in seguito a somministrazione di dosi ascendenti, un’emivita media di eliminazione di 2.0-2.7 ore, ed una clearance totale media di 4.6-6.0 L/h.
Sia l’emivita che la clearance totale sono risultate correlate inversamente e linearmente con la funzione renale.
Il volume di distribuzione di cefiderocol è pari a 13-5.16.4 L, e la frazione non legata alle proteine plasmatiche è pari a 0.35-0.42 (2).
Non sono state osservate particolari interazioni farmacologiche con i trasportatori OAT 1 e 3, OCT 1 e 2, MATE 2-K e OATP 1B3.
La penetrazione di cefiderocol nell’epitelial lining fluid polmonare è risultata simile a quella di altre cefalosporine.
Per quanto riguarda la farmacodinamica, modelli sperimentali animali hanno mostrato come il raggiungimento di 75% t>MIC sia associato ad una risposta microbiologica efficace in termini di bacterial killing (riduzione di 1-2 log), mostrando inoltre un effetto più sostenuto in caso di infusione prolungata (3 ore).
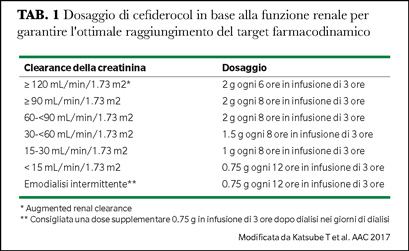 I dosaggi raccomandati di cefiderocol sono stati ottenuti sulla base dei risultati di modelli di simulazione Monte Carlo atti a garantire una probability of target attainment (PTA) ≥90% per il target di 75% t>MIC (considerando patogeni con una MIC fino a 4 mg/L), per le diverse classi di funzione renale e prevedendo anche un adattamento posologico per i pazienti con augmented renal clearance (ARC), una condizione fisiopatologica che può accelerare l’eliminazione dei beta-lattamici (Tabella 1) (2, 3).
I dosaggi raccomandati di cefiderocol sono stati ottenuti sulla base dei risultati di modelli di simulazione Monte Carlo atti a garantire una probability of target attainment (PTA) ≥90% per il target di 75% t>MIC (considerando patogeni con una MIC fino a 4 mg/L), per le diverse classi di funzione renale e prevedendo anche un adattamento posologico per i pazienti con augmented renal clearance (ARC), una condizione fisiopatologica che può accelerare l’eliminazione dei beta-lattamici (Tabella 1) (2, 3).
Studi clinici
In un trial randomizzato in doppio cieco (APEKS-cUTI), cefiderocol si è dimostrato non inferiore a imipenem-cilastatina per la terapia delle infezioni complicate delle vie urinarie (cUTI) o pielonefriti acute, con endpoint primario composito (cura clinica/eradicazione microbiologica) (4).
L’endpoint primario è stato registrato nel 73% (183/252) dei pazienti trattati con cefiderocol e nel 55% (65/119) dei pazienti trattati con imipenem-cilastatina (differenza 18.6%; 95% CI da 8.2 a 28.9), raggiungendo pertanto anche la superiorità come risultato post-hoc. Nello studio randomizzato in doppio cieco APEKS-NP cefiderocol è stato confrontato con meropenem per la terapia di HABP, HCABP e VABP (hospital- acquired bacterial pneumonia, healthcare-associated bacterial pneumonia, e ventilator-associated bacterial pneumonia, rispettivamente), in entrambi i gruppi insieme a linezolid, e con la mortalità cruda al giorno 14 come endpoint primario (5).
Tale endpoint è stato registrato nel 12.4% (18/145) dei pazienti trattati con cefiderocol e nell'11.6% (17/146) dei pazienti trattati con meropenem (differenza 0.8%, 95% CI da −6.6 a 8.2), dimostrando pertanto la non-inferiorità.
Nello studio open-label CREDIBLE-CR, cefiderocol è stato confrontato con best available therapy per la terapia di HCABP, HABP, cUTI o batteriemie da CR-GNB (6). I tassi di cura registrati sono risultati pari a 52.5% (42/80) nei pazienti trattati con cefiderocol e 50% (19/38) nei pazienti trattati con best available therapy. Nonostante i risultati simili per quanto riguarda l’endpoint primario, una mortalità maggiore in termini numerici è stata osservata nel gruppo dei pazienti trattati con cefiderocol, soprattutto in caso di polmonite e di infezione da A. baumannii.
La ragione di questo risultato non è ancora chiara, con le seguenti ipotesi che necessitano di chiarimento con ulteriori studi: (i) una reale differenza; (ii) una differenza dovuta al caso soprattutto alla luce del ridotto campione e dei tassi più alti di cura rispetto alla letteratura corrente registrati nel braccio best available therapy; (iii) l’impatto di altre cause (i decessi entro 3 giorni, difficilmente legati alla terapia, sono stati più frequentemente registrati nei pazienti trattati con cefiderocol); (iv) una maggiore frequenza di comorbidità/condizioni influenzanti la mortalità nei pazienti trattati con cefiderocol per quanto riguarda le infezioni da A. baumannii.
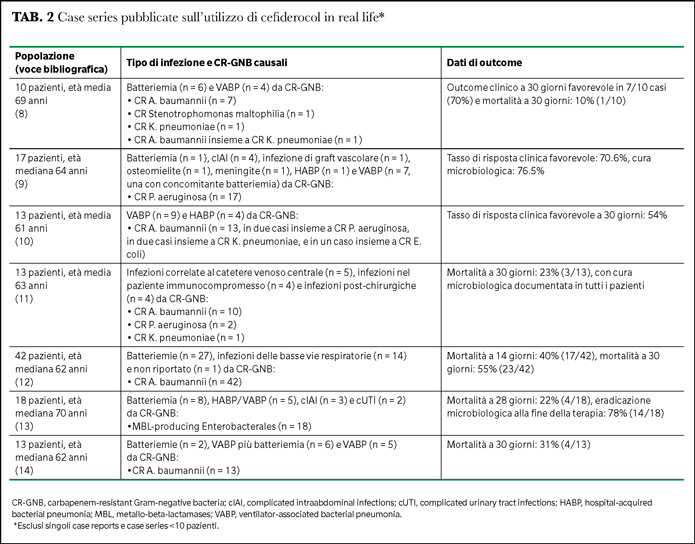
In merito agli studi osservazionali, un riassunto dei risultati delle prime case series pubblicate è disponibile in Tabella 2.
Conclusioni
L’attività di cefiderocol nei confronti di tutti i CR-GNB di maggior interesse clinico lo rende un farmaco di notevole interesse e peculiare negli scenari terapeutici attuali e futuri. Per un definitivo posizionamento vi sono due importanti considerazioni da fare.
La prima è la necessità di ulteriori studi clinici, possibilmente randomizzati, per poter meglio comprendere le ragioni sottostanti il possibile sbilanciamento in termini di mortalità osservato nello studio CREDIBLE-CR. Il secondo punto riguarda il recente rilascio delle linee guida per la terapia delle infezioni da CR-GNB da parte della Società Europea di Microbiologia Clinica e Malattie Infettive (ESCMID), che creano uno scenario del tutto nuovo per quanto riguarda la scelta delle molecole con attività anti-CR-GNB nella pratica clinica (7). Difatti, per la prima volta si hanno delle linee guida continentali per la terapia delle infezioni gravi da CR-GNB. Per quanto ciò rappresenti indubbiamente un importante risultato, l’assenza di studi ed esperienza real-life con le molecole più recentemente rese disponibili, incluso cefiderocol, non può portare attualmente a precise raccomandazioni riguardo il loro utilizzo. Ciò sottolinea ancor di più la necessità di ulteriori studi clinici, nonché di maggiori sforzi nella raccolta di dati osservazionali multicentrici e multinazionali per garantire l’evidenza utile a posizionare correttamente una molecola con caratteristiche peculiari come cefiderocol negli algoritmi terapeutici al fine di migliorare ancor più i tassi di cura delle infezioni da CR-GNB.
A tal riguardo, va segnalato infine che è stata recentemente terminata la stesura del documento “Buon Uso degli Antibiotici in Ambito Umano” per le infezioni da batteri resistenti, inclusi CR-GNB, da parte delle società scientifiche italiane SITA (Società Italiana di Terapia Antinfettiva), SIMIT (Società Italiana di Malattie Infettive e Tropicali), GISA (Gruppo Italiano per la Stewardship Antimicrobica), AMCLI (Associazione Microbiologi Clinici Italiani) e SIM (Società Italiana di Microbiologia), che sarà pertanto reso disponibile prossimamente.
- Bassetti M, Peghin M, Vena A, Giacobbe DR: Treatment of Infections Due to MDR Gram-Negative Bacteria. Frontiers in Medicine 2019;6:74.
- Giacobbe DR, Ciacco E, Girmenia C, et al. Evaluating Cefiderocol in the Treatment of Multidrug-Resistant Gram-Negative Bacilli: A Review of the Emerging Data. Infect Drug Resist 2020;13:4697-4711.
- Katsube T, Wajima T, Ishibashi T, et al. Pharmacokinetic/Pharmacodynamic Modeling and Simulation of Cefiderocol, a Parenteral Siderophore Cephalosporin, for Dose Adjustment Based on Renal Function. Antimicrob Agents Chemother 2017;61(1):e01381-16.
- Portsmouth S, van Veenhuyzen D, Echols R, et al. Cefiderocol versus imipenem-cilastatin for the treatment of complicated urinary tract infections caused by Gram-negative uropathogens: a phase 2, randomised, double-blind, non-inferiority trial. Lancet Infect Dis 2018;18(12):1319-1328.
- Wunderink RG, Matsunaga Y, Ariyasu M, et al. Cefiderocol versus high-dose, extended-infusion meropenem for the treatment of Gram-negative nosocomial pneumonia (APEKS-NP): a randomised, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis 2021;21(2):213-225.
- Bassetti M, Echols R, Matsunaga Y, et al. Efficacy and safety of cefiderocol or best available therapy for the treatment of serious infections caused by carbapenem-resistant Gram-negative bacteria (CREDIBLE-CR): a randomised, open-label, multicentre, pathogen-focused, descriptive, phase 3 trial. Lancet Infect Dis 2021;21(2):226-240.
- Paul M, Carrara E, Retamar P et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin Microbiol Infect 2021. Dec 16;S1198-743X(21)00679-0.
- Falcone M, Tiseo G, Nicastro M, et al. Cefiderocol as Rescue Therapy for Acinetobacter baumannii and Other Carbapenem-resistant Gram-negative Infections in Intensive Care Unit Patients. Clin Infect Dis 2021;72(11):2021-2024.
- Meschiari M, Volpi S, Faltoni M, et al. Real-life experience with compassionate use of cefiderocol for difficult-to-treat resistant Pseudomonas aeruginosa (DTR-P) infections. JAC Antimicrob Resist 2021;3(4):dlab188.
- Rando E, Segala FV, Vargas J, et al. Cefiderocol for Severe Carbapenem-Resistant A. baumannii Pneumonia: Towards the Comprehension of Its Place in Therapy. Antibiotics (Basel) 2021;11(1):3.
- Bavaro DF, Belati A, Diella L, et al. Cefiderocol-Based Combination Therapy for "Difficult-to-Treat" Gram-Negative Severe Infections: Real-Life Case Series and Future Perspectives. Antibiotics (Basel) 2021;10(6):652.
- Pascale R, Pasquini Z, Bartoletti M, et al. Cefiderocol treatment for carbapenem-resistant Acinetobacter baumannii infection in the ICU during the COVID-19 pandemic: a multicentre cohort study. JAC Antimicrob Resist 2021;3(4):dlab174.
- Falcone M, Tiseo G. Cefiderocol for the treatment of metallo-beta-lactamases producing Gram negative bacilli: lights and shadows from the literature. Clin Infect Dis 2022; ciac082, https://doi.org/10.1093/cid/ciac082
- Gatti M, Bartoletti M, Cojutti PG, et al. A descriptive case series of pharmacokinetic/pharmacodynamic target attainment and microbiological outcome in critically ill patients with documented severe extensively drug-resistant Acinetobacter baumannii bloodstream infection and/or ventilator-associated pneumonia treated with cefiderocol. Journal of Global Antimicrobial Resistance 2021;27:294-298.






