I pazienti con HIV-1, HTE (Highly Treatment Experienced), che albergano un virus multiresistente (MDR) rappresentano attualmente una frazione numericamente molto limitata degli oltre 120.000 pazienti in trattamento in Italia. Tra i pazienti con una lunga esposizione alla terapia e una storia di fallimenti virologici la prevalenza della resistenza alle 4 classi (NRTI, NNRTI, PI, INI) si mantiene negli anni più recenti stabilmente intorno al 2% (1). Multiresistenza, immunodeficienza e persistenza della replicazione virale sono tuttavia associate ad un aumentato rischio di progressione clinica: dati recenti del Registro Prestigio stimano una probabilità di sviluppare un evento AIDS correlato, un evento grave non-AIDS correlato o morte a 12, 24, 36, 48 mesi rispettivamente del 10, 13, 17, 22% (2). In questi pazienti, spesso con opzioni terapeutiche limitate, la disponibilità di nuovi farmaci con nuovi meccanismi d’azione è la conditio sine qua non per riconquistare il pieno controllo della replicazione virale.
è finalmente disponibile in Italia, in associazione con altri antiretrovirali, per il trattamento di tutti i pazienti adulti con HIV-1 multiresistente per i quali non sia possibile costruire un regime terapeutico soppressivo, fostemsavir (FTR), primo antiretrovirale inibitore dell’attachment virale. Il suo metabolita attivo, temsavir, si lega infatti direttamente alla gp120, in prossimità del sito di legame con il recettore CD4 e inibisce il binding tra la gp120 e il recettore CD4 ostacolando l’ingresso del virus nel linfocita e in altre cellule CD4+ (4) (3). è inoltre stato ipotizzato che il legame tra gp120 e temsavir, indipendentemente dall’attività antivirale, possa proteggere cellule non infette dai fenomeni di ADCC e prevenire la produzione di IL-10, indotta da gp120 nei monociti (5).
La dose giornaliera di FTR raccomandata nell’adulto, è di 600 mg, bid per via orale, a stomaco pieno o vuoto. Grazie all’azione della fosfatasi alcalina FTR è convertito nel lume intestinale a temsavir ed è metabolizzato attraverso l’idrolisi mediata da esterasi e l’ossidazione mediata dal citocromo P450. Poiché FTR è substrato di CYP3A4, P-gP e BCPR, è importante ricordare che la somministrazione di FTR è controindicata nei pazienti che assumono contemporaneamente forti induttori del CYP3A4 (es. carbamazepina, rifampicina, iperico), perchè associata ad una riduzione dei livelli plasmatici di FTR. Poiché FTR può inibire OATP1B1/3 la sua somministrazione è controindicata anche nei pazienti che assumono elbasvir/grazoprevir perchè vi è un aumento delle concentrazioni di grazoprevir associato ad un possibile incremento delle transaminasi. Per le DDI documentate finora in associazione a FTR, la dose giornaliera di tenofovir alafenamide raccomandata è di 10 mg, la dose di etinilestradiolo non deve superare i 30 µ/die ed è consigliabile l’utilizzo di rosuvastina alle dosi più basse. è inoltre importante sottolineare che FTR deve essere utilizzato con cautela nei pazienti con allungamento dell’intervallo QT, in particolare quando somministrato con altri farmaci con un rischio documentato di torsione di punta (es. amiodarone) o in pazienti con patologie cardiache preesistenti, clinicamente rilevanti (6).
Lo studio BRIGHTE
Grazie ai dati dello studio BRIGHTE (7-8) oggi possiamo parlare di successo virologico a lungo termine anche nei pazienti con poche opzioni terapeutiche disponibili (low treatment options-LTO). BRIGHTE (NCT 02362503) è lo studio di fase III più ampio condotto in questa popolazione in anni recenti. Sono stati arruolati 371 pazienti in fallimento virologico (HIV-RNA >400 copie/ml) con HIV-1 MDR. L’età media dei pazienti è di 50 anni, le donne rappresentano circa il 20% dei casi, l’esposizione alla terapia antiretrovirale è di oltre 20 anni nel 40% dei casi, il 73% dei pazienti ha CD4 <200 cellule/mmc e il 29% ha una viremia >100.000 copie/ml; una diagnosi di AIDS è presente in oltre l’85% dei casi. Lo studio è ancora in corso in 23 paesi e i pazienti sono stati arruolati all’interno di due coorti stabilite in base al numero di farmaci antiretrovirali attivi rimanenti. Nella prima coorte 272 pazienti con 1-2 farmaci attivi sono stati randomizzati a ricevere in cieco FTR o placebo, in un rapporto 3:1, in aggiunta al regime in atto per 8 giorni, al termine dei quali FTR è stato fornito in aperto in associazione ad una terapia di background ottimizzata (OBT) scelta a discrezione dell’investigatore.
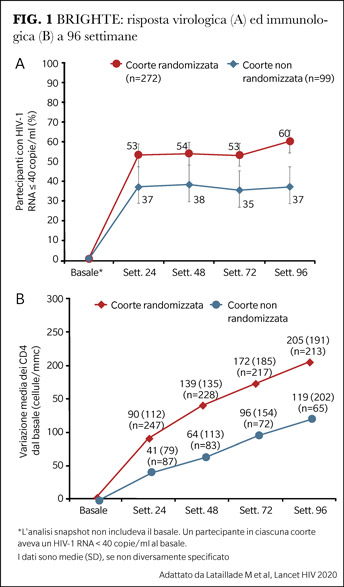 Nella seconda coorte (non randomizzata) 99 pazienti che non avevano opzioni antiretrovirali residue hanno ricevuto dal primo giorno FTR in aperto in associazione all’OBT. End-point primario dello studio è la riduzione media della viremia plasmatica a 8 giorni nella coorte randomizzata: al giorno 8 si è osservata una riduzione media della viremia plasmatica nel gruppo trattato con FTR superiore al gruppo trattato con placebo (0.79±0.05 log10 copie/ml vs 0.17±0.08 log10 copie/ml), a documentare l’attività antivirale specifica di FTR. I dati di efficacia virologica e immunologica a medio termine sono davvero incoraggianti (Figura 1): il 60% (163/272) dei pazienti nella coorte randomizzata è undetectable (HIV-RNA <40 copie/ml) a 96 settimane con un progressivo, costante incremento di linfociti T CD4+ (in media 205 cellule/µL). Anche nella coorte non randomizzata i risultati sono convincenti: il 37% dei pazienti ha riguadagnato la soppressione virologica a 24 settimane e, ancora più importante, l’ha mantenuta fino a 96 settimane con un incremento medio di 119 cellule CD4+/µL.
Nella seconda coorte (non randomizzata) 99 pazienti che non avevano opzioni antiretrovirali residue hanno ricevuto dal primo giorno FTR in aperto in associazione all’OBT. End-point primario dello studio è la riduzione media della viremia plasmatica a 8 giorni nella coorte randomizzata: al giorno 8 si è osservata una riduzione media della viremia plasmatica nel gruppo trattato con FTR superiore al gruppo trattato con placebo (0.79±0.05 log10 copie/ml vs 0.17±0.08 log10 copie/ml), a documentare l’attività antivirale specifica di FTR. I dati di efficacia virologica e immunologica a medio termine sono davvero incoraggianti (Figura 1): il 60% (163/272) dei pazienti nella coorte randomizzata è undetectable (HIV-RNA <40 copie/ml) a 96 settimane con un progressivo, costante incremento di linfociti T CD4+ (in media 205 cellule/µL). Anche nella coorte non randomizzata i risultati sono convincenti: il 37% dei pazienti ha riguadagnato la soppressione virologica a 24 settimane e, ancora più importante, l’ha mantenuta fino a 96 settimane con un incremento medio di 119 cellule CD4+/µL.
FTR è un farmaco ben tollerato. Gli eventi avversi più frequentemente riportati in BRIGHTE (cefalea, diarrea e nausea) sono eventi avversi generalmente lievi. A 96 settimane 38 pazienti hanno interrotto il trattamento: in 12 (3%) casi per eventi avversi farmaco-correlati e in 26 (7%) per eventi avversi non-farmaco correlati. In BRIGHTE si sono verificati 29 decessi, 12 (4%) nella coorte randomizzata e 17 (17%) nella coorte non randomizzata, in larga maggioranza per progressione clinica, IRIS, sviluppo di tumori e complicanze infettive, dati che sottolineano quanto la prognosi dei pazienti con infezione da HIV multiresistente sia ancora oggi delicata. Dati che ribadiscono con decisione quanto sia poco opportuno tergiversare, quanto sia cruciale introdurre il più precocemente possibile farmaci con un nuovo meccanismo d’azione, efficaci e ben tollerati nei pazienti in fallimento virologico con LTO; la voce dei pazienti misurata attraverso i PROs e il miglioramento della HRQOL riportato in BRIGHTE ne rappresentano un’espressione tangibile (9).
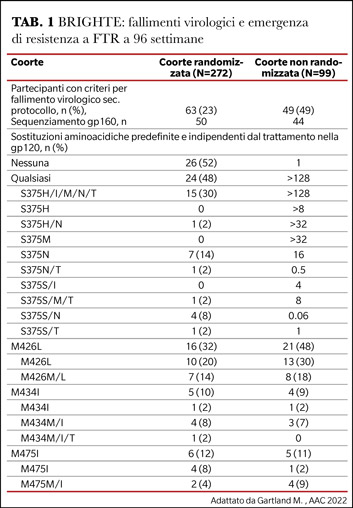 Si va delineando in questi anni il perimetro dell’attività antivirale di FTR: il farmaco non è attivo nei confronti di HIV-2 e nell’ambito dell’infezione da HIV-1 non è attivo nei confronti del gruppo O e N per la frequenza elevatissima di polimorfismi S375H e S375M/ M426L/M434I associati a resistenza naturale a FTR. All’interno del gruppo M anche il sottotipo CRF-01_AE, particolarmente frequente nel sud-est asiatico, è considerato naturalmente resistente a FTR per la presenza di polimorfismi nelle posizioni S375H e M475I. I dati in vitro trovano conferma in vivo nello studio BRIGHTE (12): il 23% dei pazienti nella coorte randomizzata è andata incontro a fallimento virologico, nel 48% dei casi associato alla emergenza di mutazioni nelle posizioni aminoacidiche S375, M426, M434, e M475 (Tabella 1).
Si va delineando in questi anni il perimetro dell’attività antivirale di FTR: il farmaco non è attivo nei confronti di HIV-2 e nell’ambito dell’infezione da HIV-1 non è attivo nei confronti del gruppo O e N per la frequenza elevatissima di polimorfismi S375H e S375M/ M426L/M434I associati a resistenza naturale a FTR. All’interno del gruppo M anche il sottotipo CRF-01_AE, particolarmente frequente nel sud-est asiatico, è considerato naturalmente resistente a FTR per la presenza di polimorfismi nelle posizioni S375H e M475I. I dati in vitro trovano conferma in vivo nello studio BRIGHTE (12): il 23% dei pazienti nella coorte randomizzata è andata incontro a fallimento virologico, nel 48% dei casi associato alla emergenza di mutazioni nelle posizioni aminoacidiche S375, M426, M434, e M475 (Tabella 1).
Nella coorte non randomizzata il fenomeno è ancora più evidente perchè la percentuale di fallimento virologico a 96 settimane è del 49% e nel 75% dei casi è associato a resistenza a FTR. Questi dati supportano ulteriormente la necessità di “proteggere” questo farmaco efficace e ben tollerato all’interno di una OBT caratterizzata da un’elevata barriera genetica. Si apre uno scenario nuovo in cui avremo modo di valutare nei pazienti con LTO efficacia e sicurezza di combinazioni completamente dirette ad inibire l’ingresso del virus nella cellula. Disponiamo di dati in vitro preliminari ma incoraggianti: la suscettibilità a FTR è mantenuta anche in pazienti con una lunga esposizione alla terapia e precedentemente trattati con enfuvirtide (11), la maggioranza di isolati virali resistenti a ibalizumab conserva suscettibilità a FTR e isolati virali con le mutazioni S375H, M426L, M475I, associate a ridotta suscettibilità a FTR, mantengono suscettibilità a maraviroc, ibalizumab ed enfuvirtide (12).
BRIGHTE ha sottolineato ancora una volta quanto sia importante l’associazione di almeno 2 farmaci attivi (13), preferibilmente con un nuovo meccanismo d’azione, ma ci ha insegnato anche a non demordere nei casi, non infrequenti, in cui FTR rappresenti l’unico farmaco attivo e disponibile. In questa condizione è fondamentale impostare in modo oculato il riciclo di antiretrovirali con attività antivirale residua in associazione a FTR. A due anni dall’inizio di FTR un terzo dei pazienti nella coorte non randomizzata ha raggiunto e mantenuto la completa soppressione virologica e nel nostro centro, come in altri centri partecipanti, vi sono pazienti aviremici da oltre 5 anni: un risultato insperato e di grande stimolo per una gestione esperta e condivisa del futuro dei pazienti con un’infezione da virus MDR e LTO.
- Lombardi F, Giacomelli A, Armenia D et al. Prevalence and factors associated with HIV-1 multi-drug resistance over the past two decades in the Italian ARCA database. Int J Antimicrob Agents. 2021;57(2):106252.
- Galli L, Parisi MR, Poli A, et al. Burden of Disease in PLWH Harboring a Multidrug-Resistant Virus: Data From the PRESTIGIO Registry. Open Forum Infect Dis. 2020;7(11):ofaa456.
- Https://farmaci.agenziafarmaco.gov.it (documento 07.06.22)
- Pancera M, Lai YT, Bylund T, et al. Crystal structures of trimeric HIV enve- lope with entry inhibitors BMS-378806 and BMS-626529. Nat Chem Biol 2017;13: 1115-22.
- Boutin M, Vézina D, Ding S, et al. Temsavir Treatment of HIV-1-Infected Cells Decreases Envelope Glycoprotein Recognition by Broadly Neutralizing Antibodies ì. 10.1128/mbio.00577-22.
- Rusca MW, Savant IA, Anderson JA, et al.Thorough QT/QTc trial to evaluate the effect of the HIV-1 attachment inhibitor BMS-626529, administered as its prodrug, BMS-663068, on QTc intervals. Abstr 15th International Workshop on Clinical Pharmacology of HIV and Hepatitis Therapy.
- Kozal M, Aberg J, Pialoux PG. Fostemsavir in Adults with Multidrug Resistant HIV-1 Infection.N Engl J Med 2020;382:1232-43.
- Lataillade M, Lalezari JP, Kozal M. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in heavily treatment-experienced individuals: week 96 results of the phase 3 BRIGHTE study. Lancet HIV. 2020; 7: e740–51.
- Anderson SJ, Murray M, Cella D et al. Patient‐Reported Outcomes in the Phase III BRIGHTE Trial of the HIV‐1 Attachment Inhibitor Prodrug Fostemsavir in Heavily Treatment‐Experienced Individuals. The Patient-Patient-Centered-Outcomes Research. 2022;15(1):131-143.
- Saladini F, Giannini A, Giammarino F et al. In vitro susceptibility to fostemsavir is not affected by long-term exposure to antiviral therapy in MDR HIV-1-infected patients . J Antimicrob Ther 2020; 75: 2547-2553.
- Rose R, Gartland M, Z. li et al. Clinical evidence for a lack of cross-resistance between temsavir and ibalizumab or maraviroc. AIDS 2022; 36:11-18
- Gartland M, Cahn P, DeJesus E, Week 96 Genotypic and Phenotypic Results of the Fostemsavir Phase 3 BRIGHTE Study in Heavily Treatment-Experienced Adults Living with Multidrug-Resistant HIV-1. AAC 2022: 21;66(6):e0175121.
- Ackerman P, Thompson M, Molina JM, et al. Long-term efficacy and safety of fostemsavir among subgroups of heavily treatment-experienced adults with HIV-1. AIDS 2021; 35:1061-≤1072.






