Grazie agli enormi progressi della ricerca, a 30 anni dall’inizio delle prime sperimentazioni cliniche, la terapia genica rappresenta oggi una realtà terapeutica sicura ed efficace per molte condizioni cliniche, quali malattie ereditarie monogeniche e tumori, che hanno opzioni terapeutiche limitate o assenti. Essa rientra nel gruppo delle cosiddette terapie avanzate, tecnicamente chiamate ATMP (Advanced Therapy Medicinal Products), ossia terapie o farmaci innovativi costituiti da DNA o RNA, cellule e tessuti, differentemente dai farmaci tradizionali che si basano su molecole di sintesi chimica. L’obiettivo della terapia genica è la correzione del gene difettoso mediante trasferimento del gene sano o attraverso una modificazione genica direttamente all’interno delle cellule del paziente nel caso delle malattie ereditarie, oppure quello di fornire una nuova funzione ad azione preventiva o terapeutica alle cellule modificate nel caso delle malattie acquisite.
Metodiche e vettori
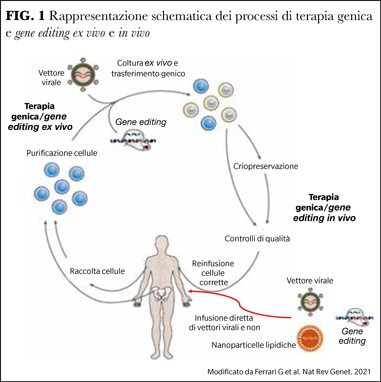 Il materiale genetico, in genere costituito da un cDNA (talvolta da RNA) codificante una proteina, può essere trasferito in due modi, ex vivo o in vivo (Figura 1). Nell’approccio ex vivo, il trasferimento del gene terapeutico avviene durante la coltura in vitro delle cellule prelevate dal paziente, per cui il prodotto medicinale è costituito dalle cellule geneticamente modificate, che vengono risomministrate al paziente (fresche o criopreservate) dopo chemioterapia. Nell’approccio in vivo, il gene viene veicolato direttamente nelle cellule o nel tessuto bersaglio per via sistemica o locale (ad es. intracerebrale o intraoculare) e il prodotto medicinale è rappresentato dal vettore integrante.
Il materiale genetico, in genere costituito da un cDNA (talvolta da RNA) codificante una proteina, può essere trasferito in due modi, ex vivo o in vivo (Figura 1). Nell’approccio ex vivo, il trasferimento del gene terapeutico avviene durante la coltura in vitro delle cellule prelevate dal paziente, per cui il prodotto medicinale è costituito dalle cellule geneticamente modificate, che vengono risomministrate al paziente (fresche o criopreservate) dopo chemioterapia. Nell’approccio in vivo, il gene viene veicolato direttamente nelle cellule o nel tessuto bersaglio per via sistemica o locale (ad es. intracerebrale o intraoculare) e il prodotto medicinale è rappresentato dal vettore integrante.
La maggior parte dei vettori utilizzati per il trasferimento genico sono di origine virale, ottenuti mediante modifiche genetiche che, da una parte, eliminano geni virali essenziali per la patogenicità e replicazione virale rendendoli innocui, e dall’altra, inseriscono il materiale genico necessario per la correzione. I vettori virali più utilizzati per la terapia genica ex vivo derivano dai γ-retrovirus (γ-RV) o lentivirus (LV). L’inserimento del gene terapeutico nel genoma virale avviene in maniera casuale, ma i LV presentano un profilo di integrazione più sicuro e controllato rispetto ai γ-RV (1). Per la terapia genica in vivo si utilizzano invece vettori derivati da adenovirus, virus adeno-associati (AAV), herpes simplex virus di tipo 1 e LV. Esistono poi dei metodi non virali per il trasferimento genico basati sulla formazione di un complesso del DNA con una molecola lipidica, oppure sull’elettroporazione, usata in particolare nell’ambito del gene editing.
Terapia genica ex vivo con CSE
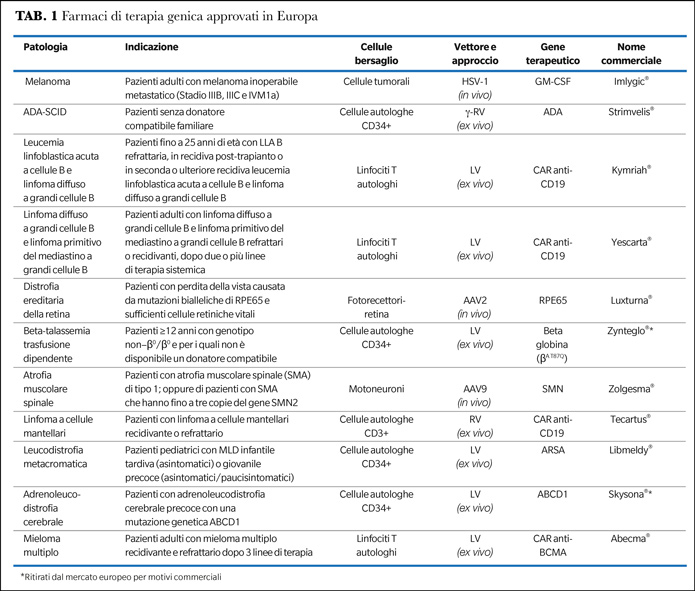
Le cellule staminali ematopoietiche (CSE) rappresentano uno dei bersagli preferiti per la terapia genica ex vivo, in quanto la modificazione genetica delle cellule multipotenti garantisce una correzione permanente e duratura della progenie (2). I principali successi di tale approccio sono stati ottenuti nell’ambito delle immunodeficienze primitive (IDP), delle emoglobinopatie e delle malattie neurometaboliche (3-6). In particolare, diversi ATMP sono stati approvati recentemente dall’EMA sulla base dei dati di sicurezza ed efficacia raccolti in oltre 10 anni di sperimentazioni cliniche, quali Strimvelis® nel maggio 2016 per il trattamento dell’ADA-SCID, Zynteglo® nel maggio 2019 per pazienti con β-talassemia trasfusione-dipendente di età ≥12 anni, Libmeldy® nel dicembre 2020 per i pazienti affetti da leucodistrofia metacromatica e, infine, Skysona® a luglio 2021 per l’adrenoleucodistrofia cerebrale precoce (Tabella 1). Risultati promettenti sono stati ottenuti anche per altre IDP e malattie metaboliche da accumulo lisosomiale. La terapia genica per queste gravi patologie offre indiscussi vantaggi rispetto all’unica terapia alternativa del trapianto allogenico poiché può essere applicata ad ogni paziente, anche quando non esista un donatore HLA compatibile, e consente di ridurre la mortalità e le complicanze dovute al trapianto allogenico, quali la reazione del trapianto contro l’ospite, il rigetto, la tossicità d’organo e le infezioni. Nelle malattie lisosomiali, inoltre, la terapia genica consente un'espressione sovrafisiologica del transgene, e di conseguenza la produzione di livelli superiori a quelli normali di enzima mancante, fornendo così un beneficio clinico maggiore rispetto al trapianto allogenico.
CAR-T
Un’altra strategia di terapia genica basata su linfociti T ingegnerizzati ex vivo con vettori virali per esprimere recettori chimerici specifici per antigeni tumorali (CAR-T) si è rivelata una potente arma nella lotta ai tumori. Risultati positivi sono stati ottenuti nel melanoma metastatico e contro diverse patologie oncoematologiche, soprattutto contro l’antigene CD19 espresso dalle cellule leucemiche linfoidi (Tabella 1) (7). Tuttavia, tali terapie possono presentare effetti collaterali anche gravi legati al rilascio massivo di citochine, tossicità d’organo e aggressione dei tessuti sani. Gli studi in corso sono volti alla produzione di CAR-T di nuova generazione associati ad un minor rischio di tali complicanze o che possano essere eliminati attraverso geni suicidi. Il successo dei CAR-T fornisce una base importante per le future terapie basate sulle cellule T per malattie come i disordini autoimmuni e l'AIDS.
Il gene editing
Un ulteriore passo in avanti nella medicina di precisione è rappresentato dalle tecniche basate sul gene editing che permette di modificare il genoma in maniera mirata grazie all’uso di endonucleasi specifiche, “forbici molecolari” che tagliano il DNA in un punto prestabilito. Tali tecniche consentono sia di silenziare l’espressione di un gene, sia di inserirne la versione corretta, con il vantaggio di ridurre il rischio residuo di mutagenesi inserzionale legato ai vettori integranti.
Gli enzimi ingegnerizzati che catalizzano la rottura della doppia elica di DNA comprendono le endonucleasi Cas9 con guida di RNA (sistema CRISPR/Cas9, che è il sistema più utilizzato), le nucleasi associate a zinc-finger e le transcriptor activator-like effector nucleases (TALENs).
Anche il gene editing può essere effettuato ex vivo ed in vivo (Figura 1), e numerose sperimentazioni precliniche e cliniche sono state avviate per valutarne sicurezza ed efficacia. È stato usato per la prima volta nell’uomo in un gruppo di pazienti affetti da HIV che hanno ricevuto l’infusione di linfociti CD4+ autologhi ingegnerizzati con endonucleasi zinc-finger per eliminare il gene CCR5, che funge da co-recettore principale di HIV, conferendo in tal modo una resistenza acquisita al virus. Lo studio clinico ha mostrato come le infusioni dei linfociti siano sicure e che le cellule modificate CCR5 persistono a lungo termine, anche per il vantaggio selettivo rispetto alle cellule non modificate (8). Da poco, inoltre, è stato approvato il primo studio sperimentale di fase I per testare nell’uomo la sicurezza e la efficacia di una terapia di gene editing in vivo basata su CRISPR/Cas9 per l’HIV. Il farmaco sperimentale basato su AAV viene somministrato per infusione endovenosa e ha lo scopo di tagliare un’ampia porzione del DNA provirale, minimizzando la sua capacità di immune escape (NCT05144386).
Risultati promettenti sono stati recentemente pubblicati anche sull’utilizzo del gene editing ex vivo in CSE per il trattamento della β-talassemia trasfusione-dipendente e dell’anemia falciforme. Lo scopo è ripristinare la produzione di emoglobina fetale (HbF), associata a ridotta morbidità e mortalità in queste gravi emoglobinopatie, mediante la distruzione del gene BCL11A, responsabile della inibizione della sintesi di gamma globina e conseguentemente della HbF. Ad un anno dalla terapia, i pazienti presentavano alti livelli di correzione genica, aumentati livelli di HbF e miglioramento clinico con indipendenza dalle trasfusioni e assenza di fenomeni vaso-occlusivi (9).
Risultati incoraggianti con il gene editing CRISPR/Cas9, questa volta in vivo, sono stati ottenuti nel trattamento dell’amiloidosi da transtiretina, una patologia fatale causata da accumulo della proteina anomala a carico di cuore e nervi. L’approccio si basa sull’infusione endovenosa di piccole sfere lipidiche contenenti al loro interno l’RNA per produrre Cas9 e lo stesso RNA-guida. I dati pubblicati mostrano una significativa riduzione dei livelli della proteina anomala con picchi anche del 96% nel primo mese, associata a miglioramento clinico in assenza di rilevanti effetti avversi (10).
- Tucci F, Galimberti S, Naldini L, et al. A systematic review and meta-analysis of gene therapy with hematopoietic stem and progenitor cells for monogenic disorders. Nat Commun. 2022; 14;13(1):1315.
- Ferrari G, Thrasher AJ, Aiuti A. Gene therapy using haematopoietic stem and progenitor cells. Nat Rev Genet. 2021; 22(4):216-234.
- Aiuti A, Slavin S, Aker M, et al. Correction of ADA-SCID by stem cell gene therapy combined with nonmyeloablative conditioning. Science 2002; 296:2410-2413.
- Marktel S, Scaramuzza S, Cicalese MP, et al. Intrabone hematopoietic stem cell gene therapy for adult and pediatric patients affected by transfusion dependent ß-thalassemia. Nat Med 2019; 5:234-241.
- Fumagalli F, Calbi V, Natali Sora MG, et al. Lentiviral haematopoietic stem-cell gene therapy for early-onset metachromatic leukodystrophy: long-term results from a non-randomised, open-label, phase 1/2 trial and expanded access. Lancet 2022; 399(10322):372-383.
- Cartier N, Hacein-Bey-Abina S, Bartholomae CC, et al. Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science 2009; 326(5954):818-23.
- Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018; 378:439-448.
- Tebas P, Stein D, Tang WW, et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. N Engl J Med. 2014; 370, 901-910.
- Frangoul H, Altshuler D, Cappellini MD, et al. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med. 2021; 384:252-60.
- Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021; 385:493-502.






