Premessa
A differenza di altre Variants of Concern (VOCs), Omicron ha sviluppato una notevole diversità ed è attualmente suddivisa in cinque linee principali (BA.1, BA.2, BA.3, BA.4 e BA.5) (1,2), con molte altre linee secondarie individuate che stanno accumulando ulteriori modifiche antigeniche (3). BA.1 ha causato un'ondata globale di infezione alla fine del 2021, ma all'inizio del 2022 è stata sostituita da BA.2.
Nell'aprile 2022 sono state riconosciute altre sub-varianti: BA.4 e BA.5, e, a partire da settembre 2022, BA.5 ha guidato una nuova ondata Omicron a livello globale (2). Più recentemente è emersa in maniera prevalente una sub-variante di BA.5 denominata BQ.1.1 (3). I lignaggi di Omicron mostrano una complessa correlazione tra loro, che probabilmente ha incluso molteplici eventi di ricombinazione intra-VOC prima dell'individuazione (2) frutto di infezioni persistenti/croniche e/o coinfezioni, delineando un'alta probabilità di virus ricombinanti (2). Dall'inizio del 2022, il numero di ricombinanti identificati è aumentato rapidamente, probabilmente a causa degli alti livelli di co-circolazione tra Delta e BA.1, o BA.1 e BA.2, in molti Paesi, in un momento di graduale eliminazione delle restrizioni COVID-19. Un esempio di virus ricombinante è XBB (sub-variante di BA.2), emerso di recente negli Stati Uniti (XBB 1.15) (3).
Scenario terapeutico attuale
Alla luce di questa premessa si rende necessario focalizzare l’obiettivo di questo articolo sulle varianti al momento circolanti in Italia e di interesse per la salute pubblica, ovvero BA.5, BQ.1.1, e in previsione di una futura diffusione, anche XBB.
Sulla base delle attuali conoscenze, le terapie che hanno come bersaglio diretto il virus SARS-CoV-2 avranno la massima efficacia se somministrate precocemente nelle prime fasi dell’infezione (oggetto di trattazione di questo articolo), mentre le terapie immunosoppressive/antinfiammatorie saranno probabilmente più utili nelle fasi successive di malattia (3).
L'obiettivo della gestione terapeutica per i pazienti non ospedalizzati è quello di prevenire la progressione verso la malattia grave, l'ospedalizzazione o la morte.
Per gli adulti ad alto rischio di progressione verso la malattia grave e con COVID-19 lieve-moderata, sono disponibili diverse opzioni terapeutiche antivirali per ridurre il rischio di ospedalizzazione o di morte, confermato da trial clinici randomizzati che ne hanno autorizzato l’approvazione da parte degli enti regolatori, tra cui:
- nirmatrelvir/ritonavir (NMV/r), somministrato per via orale (4)
- remdesivir (RDV), somministrato per soli 3 giorni per via endovenosa (5)
- molnupiravir (MPV), somministrato per via orale (6).
Per quanto riguarda invece gli anticorpi monoclonali (mAbs) ad uso terapeutico nel paziente, l’utilizzo è stato approvato nell'era pre-Omicron per: bamlanivimab/etesevimab (BAM/ETE) (7), casirivimab/imdevimab (CAS/IMD) 600/600 mg ev o sc (1200/1200 mg per il paziente ospedalizzato) (8), sotrovimab (SOT) 500 mg ev e più recentemente tixagevimab/cilgavimab (TIX/CIL) 300/300 mg im (9,10).
Le indicazioni terapeutiche di questi farmaci sono le stesse per gli antivirali orali con la differenza della tempistica, indicati per il trattamento precoce entro 7 giorni dall’esordio dei sintomi.
Tuttavia, alla luce dell’emergenza di varianti resistenti a questa combinazione, i mAbs attualmente approvati ed impiegati in pratica clinica sono sostanzialmente SOT e TIX/CIL.
Diversi fattori influenzano la scelta terapeutica, tra cui l'efficacia clinica e la disponibilità di una determinata opzione terapeutica, le potenziali interazioni farmacologiche, il tempo trascorso dall'insorgenza dei sintomi e le attività in vitro dei farmaci disponibili contro le varianti e le sotto-varianti del virus SARS-CoV-2 attualmente in circolazione.
Oltre agli studi registrativi, interessante è quanto emerge da un recente trial randomizzato inclusivo di un’ampia numerosità di popolazione (studio PANORAMIC) sull’utilizzo di MPV vs standard of care (SOC) (n=26411 di cui 12821 in MPV e 12962 SOC), ovvero, assenza di beneficio di MPV nel ridurre i tassi di ospedalizzazione/morte, di per sé già bassi in una popolazione per lo più vaccinata per COVID-19, dimostrando comunque un più veloce tempo di guarigione e ridotta carica virale (11).
Un altro studio randomizzato, di fase 4, multicentrico, italiano, in pazienti non ospedalizzati con infezione lieve-moderata e con almeno un fattore di rischio di malattia (studio MONET) ha mostrato in analisi ad interim su n= 400 pazienti, che il rischio cumulativo complessivo di fallimento clinico, in seguito ad utilizzo di NMV/r, SOT o TIX/CIL in era Omicron è basso [1.25% (95% CI 0.4%-2.89%)], seppur con alcune differenze in termini di progressione clinica tra i tre bracci (12).
Inoltre, dati preliminari provenienti sempre da questo studio hanno dimostrato in vivo un effetto antivirale maggiore di NMV/r, definito come una riduzione della carica virale di SARS-CoV-2 a 7 giorni post-trattamento, rispetto ai monoclonali in uso in pratica clinica (SOT e TIX/CIL) ed in un contesto caratterizzato per lo più dalle sotto-varianti BA.2 e BA.5 (13).
Dati provenienti da studi in vitro
Per ciò che concerne la potenziale efficacia clinica, si fa spesso riferimento, in via del tutto surrogata, ai lavori in vitro che testano la capacità di questi composti, antivirali e/o mAbs, di neutralizzare le VOC attualmente circolanti. La tabella 1 mostra lo spettro di sensibilità e la potenziale attività clinica di antivirali e mAbs attualmente in uso nella pratica clinica in Italia.
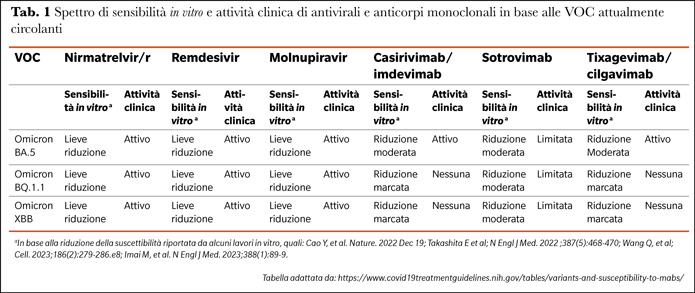
Questi dati, seppur in vitro, depongono per una certa sicurezza nell’utilizzo degli antivirali orali nello scenario epidemiologico attuale (Tabella 2).
Diverso è invece lo scenario che si delinea con l’utilizzo dei mAbs ad uso terapeutico. L'elevato numero di sostituzioni presenti nella proteina spike delle sub-varianti Omicron si associa a un'evasione immunitaria di notevole entità (14).
Inoltre gli studi in vitro hanno rilevato che l'attività dei mAbs anti-SARS-CoV-2 contro specifiche varianti e sub-varianti può variare notevolmente.
Per questo motivo, si prevede che questi farmaci possano non essere pienamente efficaci per il trattamento di COVID-19 in vivo nelle aree in cui le varianti e le sub-varianti circolanti sono resistenti.
Sono altrettanto numerosi i lavori che hanno testato in vitro l’efficacia dei mAbs di volta in volta disponibili ed in base ai quadri epidemiologici correnti, e questi dati suggeriscono che i mAbs attualmente in uso potrebbero non essere efficaci contro le varianti più recenti quali BQ.1.1 e XBB in pratica clinica (Tabella 1). Tuttavia, un dato recente proveniente da modelli murini in vivo ha dimostrato che SOT mantiene la attività nei confronti di BQ.1.1, sebbene a livelli inferiori rispetto a BA.1 e BA.2 (15).
Sulla base di questi dati in vitro la Food and Drug Administration (FDA) ad aprile 2022 ha interdetto l’utilizzo di sotrovimab, ritenuto verosimilmente inefficace nei confronti della subvariante BA.2, provvedimento non recepito tuttavia dalla European Medicines Agency (EMA) in quanto incerti su come l’attività di neutralizzazione degli anticorpi in vitro si traduca in efficacia clinica, soprattutto per gli anticorpi a doppia azione come sotrovimab con funzione effettrice tra cui la citotossicità cellulare anticorpo-dipendente (ADCC) e la fagocitosi cellulare anticorpo-dipendente (ADCP).
Real world evidence
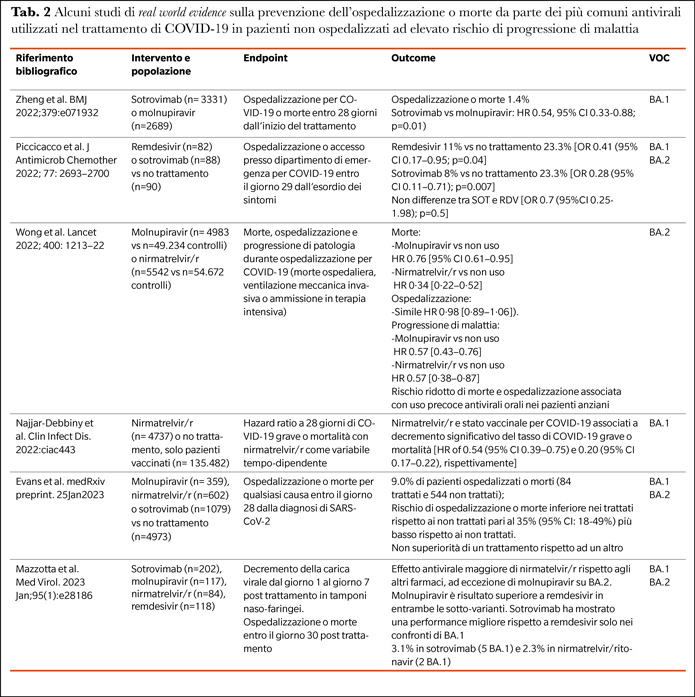
Sono disponibili alcuni studi di natura osservazionale che hanno confrontato, in pazienti con malattia da COVID-19 lieve/moderata, non ospedalizzati ad alto rischio di progressione, antivirali o mAbs in termini di riduzione del rischio relativo di ospedalizzazione e/o morte a 28 giorni dal trattamento. Si tratta al momento di studi che hanno valutato l’impatto clinico dei farmaci utilizzati in pratica clinica in periodi di osservazione che interessano la circolazione delle prime sub-varianti Omicron, prevalentemente BA.1 e BA.2, alcuni dei quali sono riportati in tabella 2, dimostrando complessivamente un vantaggio nel ridurre il rischio di ospedalizzazione in coloro che sono sottoposti a trattamento rispetto a coloro che non lo sono, con alcune differenze legate ai diversi composti ed in base alla varianti circolanti.
Conclusioni
Lo scenario terapeutico in era Omicron è in continua evoluzione, cosi come lo è SARS-CoV-2, pertanto si rende necessario un costante aggiornamento scientifico per delineare la strategia terapeutica più adatta ai pazienti, in base al contesto epidemiologico corrente ed ai principi di evolutività virale.
L’attuale pipeline comprende nuovi farmaci, al momento in fase di sperimentazione, i cui risultati preliminari sembrano essere promettenti, tra cui nuovi antivirali orali quali ensitrelvir (inibitore delle proteasi), vv116 (derivato di RDV) e il nuovo anticorpo monoclonale long-acting (AZD3152) come singola molecola o in combinazione con cilgavimab (AZD5156), attualmente in sperimentazione in uno studio di fase I/III per la profilassi pre-esposizione.
È importante ricordare che, sebbene questi trattamenti siano efficaci nel ridurre la gravità della sintomatologia e nel prevenire l'ospedalizzazione e la morte delle persone con COVID-19, essi non sostituiscono la vaccinazione, che rimane la strategia più efficace per prevenire la malattia grave.
- Carabelli AM, Peacock TP, Thorne LG, et al. SARS-CoV-2 variant biology: immune escape, transmission and fitness. Nat Rev Microbiol. 2023;21(3):162-177.
- Tracking SARS-CoV-2 variants. WHO. https://www.who.int/activities/tracking-SARS-CoV-2-variants
- COVID-19 Treatmente guidelines. Clinical Managementì of Adults. Last Update December 2022. https://www.covid19treatmentguidelines.nih.gov/management/clinical-management-of-adults/clinical-management-of-adults-summary/
- Hammond J, Leister-Tebbe H, Gardner A, et al; EPIC-HR Investigators. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19. N Engl J Med. 2022;386(15):1397-1408.
- Gottlieb RL, Vaca CE, Paredes R, et al; GS-US-540-9012 (PINETREE) Investigators. Early Remdesivir to Prevent Progression to Severe Covid-19 in Outpatients. N Engl J Med. 2022;386(4):305-315.
- Jayk Bernal A, Gomes da Silva MM, Musungaie DB, et al; MOVe-OUT Study Group. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med. 2022;386(6):509-520.
- Chen P, Behre G, Hebert C, et al. Bamlanivimab and Etesevimab Improve Symptoms and Associated Outcomes in Ambulatory Patients at Increased Risk for Severe Coronavirus Disease 2019: Results From the Placebo-Controlled Double-Blind Phase 3 BLAZE-1 Trial. Open Forum Infect Dis. 2022;9(5):ofac172.
- Weinreich DM, Sivapalasingam S, Norton T, et al; Trial Investigators. REGEN-COV Antibody Combination and Outcomes in Outpatients with Covid-19. N Engl J Med. 2021;385(23):e81.
- Gupta A, Gonzalez-Rojas Y, Juarez E, et al; COMET-ICE Investigators. Effect of Sotrovimab on Hospitalization or Death Among High-risk Patients With Mild to Moderate COVID-19: A Randomized Clinical Trial. JAMA. 2022;327(13):1236-1246.
- Montgomery H, Hobbs FDR, Padilla F, et al; TACKLE study group. Efficacy and safety of intramuscular administration of tixagevimab-cilgavimab for early outpatient treatment of COVID-19 (TACKLE): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2022;10(10):985-996.
- Butler CC, Hobbs FDR, Gbinigie OA et al.; PANORAMIC Trial Collaborative Group. Molnupiravir plus usual care versus usual care alone as early treatment for adults with COVID-19 at increased risk of adverse outcomes (PANORAMIC): an open-label, platform-adaptive randomised controlled trial. Lancet. 2023;401(10373):281-293.
- Mazzotta V, Lanini S, Fabeni L, et al. A randomized trial on early therapies among outpatients COVID-19 in the Omicron era. CROI 2023 abs 564.
- Mazzotta V, Lanini S, Matusali G. SARS-CoV-2 viral load change in a randomized trial on three different early therapies. CROI 2023 abs 563.
- Cameroni E, Bowen JE, Rosen LE, et al. Broadly neutralizing antibodies overcome SARS-CoV-2 Omicron antigenic shift. Nature. 2022;602(7898):664-670.
- Driouich JS, Bernardin O, Touret F, et al. In vivo activity of Sotrovimab against BQ.1.1 Omicron sublineage. bioRxiv preprint doi: https://doi.org/10.1101/2023.01.04.522629
- Mazzotta V, Cozzi Lepri A, Colavita F, et al; INMI COVID-19 Outpatient Treatment Study Group. Viral load decrease in SARS-CoV-2 BA.1 and BA.2 Omicron sublineages infection after treatment with monoclonal antibodies and direct antiviral agents. J Med Virol. 2023;95(1): e28186.






