L’impiego di terapie antiretrovirali altamente efficaci (HAART) ha determinato strepitosi miglioramenti nella storia naturale dell’infezione da HIV. Questi regimi terapeutici sono in grado di sopprimere in maniera estremamente efficace e, contestualmente, garantire una qualità di vita ottimale delle persone con infezione da HIV, sia attraverso una ottima tollerabilità che un impatto irrilevante sui parametri di laboratorio. Nonostante tutto ciò, la garanzia di una efficacia duratura della HAART prerequisito fondamentale per il raggiungimento di una riacquistata qualità di vita e longevità tra le persone con infezione da HIV, è ancora adombrata dal fenomeno della multi-drug resistance (MDR) di HIV (1).
La resistenza a molteplici classi farmacologiche nei soggetti HIV-positivi merita tutta la nostra attenzione, poiché può significare un deterioramento, anche repentino, della persona infettata da un virus MDR, ma anche un fattore importante per la trasmissione di nuove infezioni provocate da un HIV MDR.
La causa del fenomeno MDR nell’era pre-HAART, risultava la sommatoria di terapie, solo parzialmente efficaci nel sopprimere la replicazione virale (2). La terapia HAART, ha reso HIV un’infezione che si può controllare a lungo termine, nondimeno la terapia sub-ottimale iniziale ha portato alla selezione di resistenze farmacologiche (2-3).
Oltre a questo elemento, acquisibile da parte dello specialista infettivologo, sono emersi progressivamente altri elementi che hanno contribuito alla costruzione di virus MDR:
a) aderenza non ottimale, con conseguente mancato raggiungimento di concentrazioni farmacologiche efficaci - il fenomeno può essere inteso anche come aderenza asimmetrica: nei confronti di singoli componenti della combinazione terapeutica;
b) terapia aggiuntiva di un singolo composto, verosimilmente più frequente alcuni anni fa e implicata direttamente nel favorire l’accumulo di mutazioni che danno origine alla resistenza progressiva;
c) comorbosità ed interazioni farmacologiche, che possono, anche in presenza della corretta assunzione del farmaco, rendere inefficace la terapia antiretrovirale.
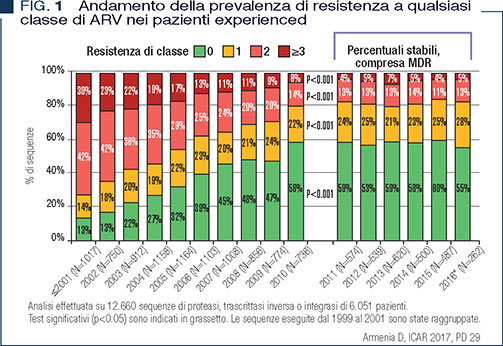 La prevalenza di ceppi HIV MDR in Italia è andata decrescendo fino al 2010, quando si è stabilizzata tra il 4 e il 7% (4) (Figura 1). E’ da sottolineare che, in questa vasta casistica condotta su 12.660 sequenze provenienti da 6.051 pazienti, il 45% delle sequenze mostrava almeno una mutazione che giustifica la resistenza farmacologica. Il ruolo delle mutazioni genotipiche non è chiaramente tutto uguale, ma è innegabile che un virus mutato è in grado di accumulare altre mutazioni in più regioni enzimatiche se la replcazione virale non è perfettamente controllata, e che il fenomeno è strettamente connesso alla capacità replicativa (5).
La prevalenza di ceppi HIV MDR in Italia è andata decrescendo fino al 2010, quando si è stabilizzata tra il 4 e il 7% (4) (Figura 1). E’ da sottolineare che, in questa vasta casistica condotta su 12.660 sequenze provenienti da 6.051 pazienti, il 45% delle sequenze mostrava almeno una mutazione che giustifica la resistenza farmacologica. Il ruolo delle mutazioni genotipiche non è chiaramente tutto uguale, ma è innegabile che un virus mutato è in grado di accumulare altre mutazioni in più regioni enzimatiche se la replcazione virale non è perfettamente controllata, e che il fenomeno è strettamente connesso alla capacità replicativa (5).
Di fronte al fallimento virologico e con la preoccupazione dell’emergenza di un virus MDR, quali principi terapeutici devono essere impiegati dalla seconda linea terapeutica in avanti? Abbiamo esempi di successo (2 studi quali BENCHMRK (6) e EARNEST (7), che sono stati condotti rispettivamente in soggetti INI-naive e PI-naive) che hanno utilizzato classi di farmaci nuove o non impiegate precedentemente quando il bagaglio farmacologico non era così attrezzato come oggi, ma che senza dubbio hanno applicato giudiziosamente i principi della rotazione farmacologica.
La costruzione di un nuovo regime terapeutico non è compito facile e necessita della conoscenza e dell’applicazione di alcuni principi fondamentali, come esplicitato nelle nostre linee guida (8). E’ necessario utilizzare farmaci con una cross-resistenza limitata con composti assunti in occasione dei precedenti fallimenti terapeutici: è indicato costruire regimi che comprendano 2, meglio 3 farmaci attivi o farmaci che siano almeno parzialmente attivi. Mirare all’uso di farmaci con una barriera genetica elevata ed in tal modo prevenire la mutagenesi virale e la compromissione di opzioni future.
Migliorare l’aderenza e monitorare strettamente il paziente: il rischio di un’aderenza sub-ottimale è la selezione di popolazioni minoritarie che albergano mutazioni, ma che possono passare inosservate con i metodi diagnostici tradizionali (Sanger vs NGS) (9) e questa è una drammatica realtà nei Paesi a risorse limitate, come mostrato da una recente meta-analisi (10).
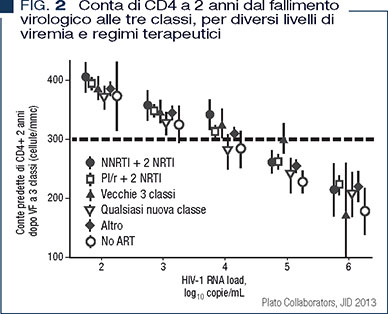 Nel caso di una soppressione virologica ottimale non sia ottenibile lo studio Plato II (pazienti con fallimento antiretrovirale a 3 classi) ha indicato che anche una soppressione virologica parziale può mantenere livelli più elevati di linfociti CD4 rispetto al mancato controllo virologico, includendo l’essere off-therapy (11) (Figura 2).
Nel caso di una soppressione virologica ottimale non sia ottenibile lo studio Plato II (pazienti con fallimento antiretrovirale a 3 classi) ha indicato che anche una soppressione virologica parziale può mantenere livelli più elevati di linfociti CD4 rispetto al mancato controllo virologico, includendo l’essere off-therapy (11) (Figura 2).
Esistono nuovi agenti per il trattamento di infezioni da HIV con replicazione virale non controllata: i farmaci in stato più avanzato di sviluppo clinico per il trattamento di virus MDR sono fostemsavir (pro-farmaco: quando è metabolizzato si lega alla proteina virale gp120 al fine di prevenire l’attacco al recettore CD4 e quindi bloccare l’entrata di HIV nella cellula ospite), ibalizumab (anticorpo monoclonale umanizzato anti-CD4) e PRO140 (anticorpo monoclonale umanizzato anti-CCR5), di cui a breve speriamo di poter disporre.
Concludendo, anche se nuovi composti con peculiari meccanismi d’azione appaiono molto promettenti, il test di resistenza genotipico, e probabilmente fenotipico, avrà ancora un’importanza fondamentale per la scelta del trattamento e la corretta gestione dell’infezione da HIV sostenuta da virus MDR.
Bibliografia
- Tang MW, Shafer RW. HIV-1 antiretroviral resistance: scientific principles and clinical applications. Drugs. 2012; 72:e1-25.
- Richman DD. Editorial Commentary: HIV Is Putting Up Less Resistance. Clin Infect Dis. 2016; 62:1318-1319.
- Harris M, Nosyk B, Harrigan R, Lima VD, Cohen C, Montaner J. Cost-Effectiveness of Antiretroviral Therapy for Multidrug-Resistant HIV: Past, Present, and Future. AIDS Res Treat. 2012; 2012:595762.
- Armenia D, Di Carlo D, Borghi V, et al. Is the management of HIV-1 drug-resistance still a clinical concern? A large Italian real life update in the modern antiretroviral era. 9° ICAR, 12-14 giugno 2017, Siena. Abstract PD29.
- Theys K, Libin P, Pineda-Peña AC, et al. The impact of HIV-1 within-host evolution on transmission dynamics. Curr Opin Virol. 2018; 28:92-101.
- Eron JJ, Cooper DA, Steigbigel RT, et al. Efficacy and safety of raltegravir for treatment of HIV for 5 years in the BENCHMRK studies: final results of two randomised, placebo-controlled trials. Lancet Infect Dis. 2013; 13:587-596.
- Paton NI, Kityo C, Hoppe A, et al. Assessment of second-line antiretroviral regimens for HIV therapy in Africa. N Engl J Med. 2014; 371:234-247.
- Linee Guida Italiane sull’utilizzo della Terapia Antiretrovirale e la gestione diagnostico-clinica delle persone con infezione da HIV-1. Edizione 2017. http://www.salute.gov.it/imgs/C_17_pubblicazioni_2696_allegato.pdf
- Casadello M, Parades R. Deep sequencing for HIV-1 clinical management. Viruses. 2017 Jul 15; 239-69-81.
- Gupta RK, Gregson J, Parkin N, et al. HIV-1 drug resistance before initiation or re-initiation of first-line antiretroviral therapy in low-income and middle-income countries: a systematic review and meta-regression analysis. Lancet Infect Dis. 2018; 18:346-355.
- Costagliola D, Ledergerber B, Torti C, et al. for the Plato Collaboration. Predictors of CD4(+) T-cell counts of HIV type 1-infected persons after virologic failure of all 3 original antiretroviral drug classes. J Infect Dis. 2013; 207:759-767.






