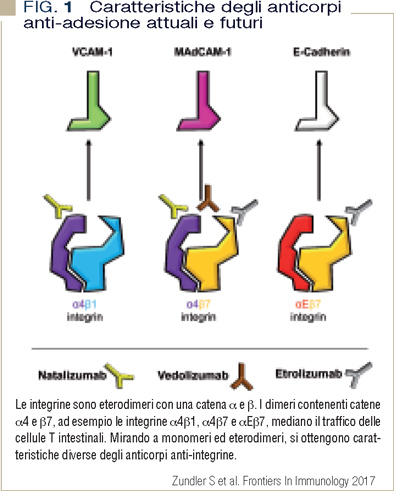
 Una delle opzioni terapeutiche consolidatesi nell’ultimo decennio per diverse patologie a genesi immuno- mediata, è rappresentata dai farmaci che interferiscono con una delle complesse fasi del trafficking e dell’homing linfocitario, idealmente agendo laddove si verifica il processo infiamatorio. Natalizumab è un anticorpo monoclonale che blocca la subunità α4 delle integrine espresse sulla superficie linfocitaria (Figura 1).
Una delle opzioni terapeutiche consolidatesi nell’ultimo decennio per diverse patologie a genesi immuno- mediata, è rappresentata dai farmaci che interferiscono con una delle complesse fasi del trafficking e dell’homing linfocitario, idealmente agendo laddove si verifica il processo infiamatorio. Natalizumab è un anticorpo monoclonale che blocca la subunità α4 delle integrine espresse sulla superficie linfocitaria (Figura 1).
Le integrine sono una classe di eterodimeri mediante le quali i leucociti aderiscono alle cellule endoteliali. L’adesione all’endotelio è un passaggio fondamentale in assenza del quale il linfocita non può abbandonare il torrente circolatorio per raggiungere il distretto corporeo nel quale deve espletare le sue funzioni. Natalizumab si lega sia all’eterodimero linfocitario α4β7, che riconosce la molecola di adesione MAdCAM-1 espressa selettivamente dalle cellule endoteliali del distretto gastroenterico; sia ad α4β1, il cui ligando è VCAM-1, molecola di adesione che, a differenza di MAdCAM-1, viene espressa sull’endotelio in molteplici distretti corporei (Figura 1).
In virtù della sua molteplicità di legame, l’uso di natalizumab dal 2006 è autorizzato per il trattamento sia dei pazienti con sclerosi multipla relapsing remittent (RRMS) sia dei pazienti con malattia di Crohn (CD). Vedolizumab è un altro anticorpo monoclonale antiadesione, possiede però uno spettro più ristretto. Si lega infatti selettivamente all’eterodimero α4β7 (ligando di MAdCAM-1) e blocca pertanto l’homing linfocitario solo a livello gastroenterico. Vedolizumab è registrato dal 2013 per l’uso nei pazienti con CD o colite ulcerosa (UC) (Figura 1).
Un altro anticorpo anti-adesione in fase di registrazione per i pazienti con malattie infiammatorie croniche dell’intestino è etrolizumab. Si lega alla subunità β7 dell’eterodimero delle integrine: anch’esso inibisce il legame dei linfociti che esprimono α4β7 a MAdCAM-1, sull’endotelio dei vasi del tratto gastroenterico; blocca però anche l’interazione tra i linfociti T αΕβ7, localizzati prevalentemente nelle mucose, con lo specifico ligando E-caderina sulle cellule epiteliali delle mucose stesse (Figura 1) (1, 2).
Fingolimod è il primo farmaco orale registrato (2010) per il trattamento della sclerosi multipla RR. Non è un biologico in senso stretto, essendo questa definizione spesso riservata agli anticorpi monoclonali, tuttavia il suo meccanismo d’azione si inserisce nel contesto di quelli sopra descritti. Si lega al recettore S1P (sphingosin 1-phosphate) presente, tra gli altri distretti, sull’endotelio negli organi linfoidi e a livello della sostanza bianca del SNC. Il legame di fingolimod a S1P sostanzialmente intrappola i linfociti T e B nei linfonodi, riducendone la ricircolazione sia in periferia che nel SNC (3).
Meccanismi d’azione
Definire anche in modo molto schematico i meccanismi di azione di questi farmaci è importante per comprendere come uno spettro d’azione molto selettivo, possa in qualche misura essere gravato dal mantenimento di pathway alternativi di attività della malattia e, quindi, da una efficacia potenzialmente inferiore.

Al contrario l’inibizione di molteplici vie metaboliche, finalizzata a limitare in modo massimale l’homing linfocitario, può incorrere nel rischio di una minore sicurezza essendo i vari pathway metabolici non esclusivi di un solo distretto corporeo. Complessivamente le molecole anti-adesione mostrano un buon profilo di sicurezza se confrontate con altre classi di biologici utilizzati per le medesime patologie (Figura 2).
I dati sulle infezioni
Con i vari antagonisti di TNF, sia i pazienti reumatologici, che i pazienti con IBD, hanno un RR intorno a 1.3-1.5 di sviluppare infezioni gravi rispetto ai gruppi di controllo.
Nei pazienti in terapia con natalizumab le infezioni delle vie respiratorie, le infezioni delle vie urinarie, le gastroenteriti hanno un’incidenza superiore rispetto alle popolazioni di controllo, ma non raggiungono mai una differenza significativa.
Le manifestazioni erpetiche, sia da VZV che da HSV, destano una particolare attenzione soprattutto per la segnalazione di forme neurologiche e disseminate di particolare gravità, tuttavia anche in questo caso si tratta di eventi estremamente rari (in un ordine di grandezza pari a circa 1 caso per 1.000 py) e comunque con un’incidenza non significativamente superiore alle popolazioni di controllo.
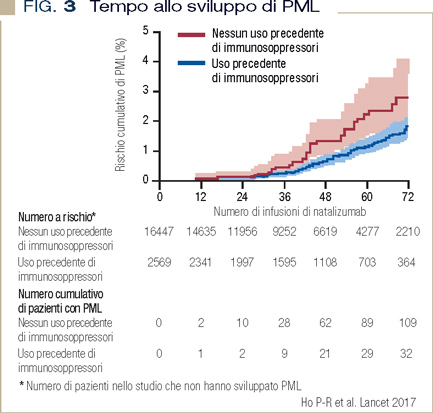 La complicanza cruciale associata all’uso di natalizumab è rappresentata dalla leucoencefalopatia multifocale progressiva (PML) conseguente alla riattivazione dell’infezione latente da JC virus. Gli eventi sono comunque rari, ma la gravità della complicanza è tale da essere particolarmente temuta. Poco dopo la registrazione di natalizumab, vi fu la segnalazione di un caso di PML in un paziente trattato per CD. Questo comportò da subito una forte limitazione al suo uso nei pazienti con IBD. Nei pazienti trattati con natalizumab per RRMS, sono stati segnalati al giugno 2017, oltre 730 casi di PML, con un’incidenza intorno a 4.2 casi/1.000 così trattati e una mortalità intorno al 24% (fortunatamente inferiore nel caso di tempestiva interruzione del trattamento dopo diagnosi precoce della malattia) (4). Le condizioni di rischio riconosciute per lo sviluppo di PML nei pazienti in terapia con natalizumab sono: la presenza di anticorpi anti-JCV nel siero, il pregresso uso di farmaci immunosoppressori, il trattamento prolungato con natalizumab (Figura 3).
La complicanza cruciale associata all’uso di natalizumab è rappresentata dalla leucoencefalopatia multifocale progressiva (PML) conseguente alla riattivazione dell’infezione latente da JC virus. Gli eventi sono comunque rari, ma la gravità della complicanza è tale da essere particolarmente temuta. Poco dopo la registrazione di natalizumab, vi fu la segnalazione di un caso di PML in un paziente trattato per CD. Questo comportò da subito una forte limitazione al suo uso nei pazienti con IBD. Nei pazienti trattati con natalizumab per RRMS, sono stati segnalati al giugno 2017, oltre 730 casi di PML, con un’incidenza intorno a 4.2 casi/1.000 così trattati e una mortalità intorno al 24% (fortunatamente inferiore nel caso di tempestiva interruzione del trattamento dopo diagnosi precoce della malattia) (4). Le condizioni di rischio riconosciute per lo sviluppo di PML nei pazienti in terapia con natalizumab sono: la presenza di anticorpi anti-JCV nel siero, il pregresso uso di farmaci immunosoppressori, il trattamento prolungato con natalizumab (Figura 3).
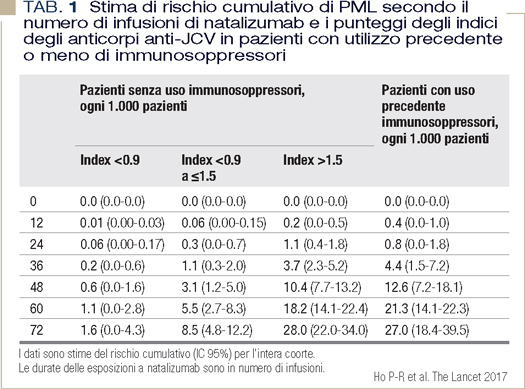 Il rischio di sviluppare PML nei pazienti in terapia con natalizumab per RRMS, che non abbiano ricevuto precedenti trattamenti immunosoppressivi, può essere meglio stimato mediante la quantificazione degli anticorpi anti-JCV nel siero mediante STRATIFY JCV test®. Il valore espresso è una ratio tra quello misurato nel paziente, rispetto al valore del calibratore positivo. Antibody index inferiori a 0.9 sono considerati a basso rischio; valori compresi tra 0.9 e 1.5 a rischio moderato; antibody index > 1.5 a rischio molto alto. Il valore non va però estrapolato in modo estemporaneo, ma contestualizzato e soprattutto posto in relazione alla durata del trattamento con immunosoppressori che costituisce, a prescindere, la condizione di rischio principale (Tabella 1) (5). Il test è dotato di una elevata sensibilità ma non di un’altissima specificità: il 40% dei pazienti ha un index >0.9 e il 30% >1.5, ma quasi la totalità di questi pazienti non svilupperà PML. Il rischio stimato fornisce anche indicazioni circa l’intervallo temporale che prudenzialmente deve intercorrere tra le RMN di controllo finalizzate a diagnosi molto precoci di un eventuale insorgenza di PML.
Il rischio di sviluppare PML nei pazienti in terapia con natalizumab per RRMS, che non abbiano ricevuto precedenti trattamenti immunosoppressivi, può essere meglio stimato mediante la quantificazione degli anticorpi anti-JCV nel siero mediante STRATIFY JCV test®. Il valore espresso è una ratio tra quello misurato nel paziente, rispetto al valore del calibratore positivo. Antibody index inferiori a 0.9 sono considerati a basso rischio; valori compresi tra 0.9 e 1.5 a rischio moderato; antibody index > 1.5 a rischio molto alto. Il valore non va però estrapolato in modo estemporaneo, ma contestualizzato e soprattutto posto in relazione alla durata del trattamento con immunosoppressori che costituisce, a prescindere, la condizione di rischio principale (Tabella 1) (5). Il test è dotato di una elevata sensibilità ma non di un’altissima specificità: il 40% dei pazienti ha un index >0.9 e il 30% >1.5, ma quasi la totalità di questi pazienti non svilupperà PML. Il rischio stimato fornisce anche indicazioni circa l’intervallo temporale che prudenzialmente deve intercorrere tra le RMN di controllo finalizzate a diagnosi molto precoci di un eventuale insorgenza di PML.
.jpg) Vedolizumab esibisce un buon profilo di sicurezza negli studi controllati e in quelli osservazionali. Non vi sono evidenze di aumento nell’incidenza di infezioni gravi rispetto alle popolazioni di controllo. Le complicanze infettive descritte sono in larga misura di grado lieve/moderato. Nella metà dei casi circa, si tratta di affezioni a carico delle vie aeree superiori, al secondo posto in ordine di frequenza vi sono le infezioni addominali (6) (Tabella 2) (6).
Vedolizumab esibisce un buon profilo di sicurezza negli studi controllati e in quelli osservazionali. Non vi sono evidenze di aumento nell’incidenza di infezioni gravi rispetto alle popolazioni di controllo. Le complicanze infettive descritte sono in larga misura di grado lieve/moderato. Nella metà dei casi circa, si tratta di affezioni a carico delle vie aeree superiori, al secondo posto in ordine di frequenza vi sono le infezioni addominali (6) (Tabella 2) (6).
Come ampiamente atteso per le IBD, gli ascessi sono più comuni nei pazienti con CD rispetto alle UC, ma si osservano comunque con maggiore frequenza nelle popolazioni di controllo, rispetto a quelle in terapia con vedolizumab. Al contrario le gastroenteriti sono più comuni nei pazienti che ricevono vedolizumab e in particolare solo in questo gruppo sono state descritte enteriti da Clostridium difficile o CMV.
Può essere suggestivo pensare che il meccanismo d’azione di vedolizumab (il blocco selettivo dell’homing linfocitario a livello gastro-enterico) abbia una relazione con la particolare incidenza di determinate eziologie. Al momento non sono riportati casi di PML, né di infezioni opportunistiche gravi, né un aumento nell’incidenza di manifestazioni da HSV/VZV. Fingolimod determina un sequestro linfocitario a livello linfonodale, reversibile al momento della sospensione del trattamento.
Questa condizione di grave e protratta linfopenia però (linfociti < 500/mmc), verosimilmente finisce per comportarsi come una sorta di deficit funzionale dell’immunosorveglianza. Non sembra casuale una peculiarità osservata nei pazienti che ricevono fingolimod per più di 2 anni. La quasi totalità delle infezioni opportunistiche gravi descritte con fingolimod e segnatamente quelle criptococciche, si sono verificate dopo il secondo anno di trattamento, mentre con tutti i biologici è ampiamente documentato che le infezioni opportunistiche gravi si manifestano quasi esclusivamente nei primi 6-12 mesi di terapia. La sintomatologia da infezione da HSV e VZV anche grave, ha una frequenza di circa due volte nei pazienti che ricevono fingolimod rispetto ai controlli, ma l’incidenza non sembra subire variazioni nel periodo di trattamento.
Bibliografia
- Hindryckx P, Novak G, Bonovas S, Peyrin-Biroulet L, Danese S. Infection Risk With Biologic Therapy in Patients With Inflammatory Bowel Disease. Clin Pharmacol Ther. 2017 Oct; 102(4):633-641. doi:10.1002/cpt.791. Epub 2017 Aug 16. Review.
- Zundler S, Becker E, Weidinger C, Siegmund B. Anti-Adhesion Therapies in Inflammatory Bowel Disease-Molecular and Clinical Aspects. Front Immunol. 2017 Jul 28; 8:891. doi:10.3389/fimmu.2017.00891. eCollection 2017. Review.
- Levin SN, Kaplan TB. Infectious Complications of Novel Multiple Sclerosis Therapies. Curr Infect Dis Rep. 2017 Feb; 19(2):7. doi:10.1007/s11908-017-0562-0. Review.
- Reuwer AQ, Heron M, van der Dussen D, et al. The clinical utility of JC virus antibody index measurements in the context of progressive multifocal leukoencephalopathy. Acta Neurol Scand. 2017 Nov; 136 Suppl 201:37-44. doi:10.1111/ane.12840.
- Ho PR, Koendgen H, Campbell N, et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy in patients with mltiple sclerosis: a retrospective analysis of data from four clinical studies. Lancet Neurol. 2017 Nov; 16(11):925-933. doi: 10.1016/S1474-4422(17)30282-X. Epub 2017 Sep 29.
- Colombel JF, Sands BE, Rutgeerts P, et al. The safety of vedolizumab for ulcerative colitis and Crohn’s disease. Gut. 2017 May; 66(5):839-851. doi:10.1136/gutjnl-2015-311079. Epub 2016 Feb 18.






