Negli anni Ottanta, alle donne HIV+ veniva sconsigliato il concepimento e alla donna sieropositiva in gravidanza veniva spesso consigliato l’aborto, in quanto il rischio di contagio al bambino era elevato e soprattutto l’aspettativa di vita delle persone sieropositive era bassa.
 Fortunatamente, con i primi trial condotti negli anni Novanta come l’ACTG 076 (1), si sono iniziate a definire delle strategie per ridurre il rischio di trasmissione, via via sempre più efficaci, che hanno reso possibile e sicuro il percorso nascita nella mamma HIV positiva (Figura 1).
Fortunatamente, con i primi trial condotti negli anni Novanta come l’ACTG 076 (1), si sono iniziate a definire delle strategie per ridurre il rischio di trasmissione, via via sempre più efficaci, che hanno reso possibile e sicuro il percorso nascita nella mamma HIV positiva (Figura 1).
Un punto chiave è stato aver capito l’importanza dell’azzeramento della carica virale di HIV materna per evitare la trasmissione fetale. Tale concetto rientra in quello più generale di U=U ovvero undetectable=untrasmissible, slogan di grande attualità, soprattutto, per la trasmissione sessuale. Il protocollo classico seguito nei paesi occidentali è composto da 6 punti che comprendono:
- diagnosi precoce di infezione da HIV nella donna
- terapia antiretrovirale (ARV) alla mamma in gravidanza
- parto cesareo laddove indicato/parto vaginale
- AZT intra-partum (non sempre indicato)
- profilassi post-natale al neonato
- allattamento artificiale.
Con tale protocollo il tasso di trasmissione si è estremamente ridotto arrivando a percentuali vicine allo zero.
Negli ultimi anni sono emersi dati solidi che hanno permesso di escludere in sicurezza da tale protocollo nelle donne persistentemente aviremiche il parto cesareo e l’AZT intra-partum: si è mantenuto un tasso di trasmissione bassissimo. Le linee guida italiane sull’utilizzo dei farmaci antiretrovirali e sulla gestione diagnostico-clinica delle persone con infezione da HIV dal 2013, in sintonia con le più importanti linee guida europee e americane, indicano che una donna HIV+ in terapia ARV efficace (HIV-RNA <50 da almeno 4 settimane prima del parto e CD4>200 cell/mmc), se le condizioni ostetriche lo permettono, può effettuare il parto vaginale senza AZT intra-partum (2). Il taglio cesareo elettivo è invece sempre raccomandato come misura efficace nel prevenire la trasmissione dell’HIV al neonato in presenza di carica virale rilevabile. Le linee guida americane e britanniche scelgono come cut-off per parto cesareo e AZT intra-partum >499-1000 cp/ml di HIV-RNA (3, 4). Anche la terapia post-natale con AZT in sciroppo al neonato, di regola di 6 settimane, ha subito delle modifiche negli anni, riducendosi di durata nei casi di donne persistentemente aviremiche. Nelle linee guida DHHS e italiane vengono consigliate 4 settimane, mentre sono 2 settimane nelle recenti BHIVA per le donne definite very low risk (3,4). Nelle linee guida svizzere (5) la profilassi post-natale è stata addirittura eliminata nelle donne con due determinazioni di HIV < 50 prima del parto a seguito della pubblicazione di alcuni studi importanti ed estrapolando il concetto U=U nella trasmissione sessuale.
Uno studio tedesco e l’esperienza francese su 2651 donne pretrattate prima della gravidanza, che hanno continuato il trattamento durante i 9 mesi arrivando al parto con HIV-RNA < 50, dimostrano l’assenza di trasmissione di HIV al bambino anche in mancanza di profilassi post-natale (6, 7). Al contrario, nel caso in cui la mamma arrivi al parto viremica, va praticata profilassi neonatale con una triplice terapia (epivir, AZT e nevirapina nelle linee guida italiane).
Quindi, allo stato attuale delle conoscenze la carica virale plasmatica materna è il fattore principale di rischio per la trasmissione verticale, per cui la terapia antiretrovirale rappresenta la più efficace misura preventiva e, quindi, riveste un ruolo centrale.
Scelta della terapia antiretrovirale in gravidanza
Al momento, nessuno dei farmaci più comunemente usati è controindicato in assoluto, in quanto nessuna tossicità è stata così evidente da superare il dato di efficacia. L’indicazione più forte è, invece, quella di iniziare il prima possibile la terapia ARV in gravidanza, se ancora non in atto, di non sospenderla mai, salvo evidenti tossicità, e di sostituirla rapidamente quando necessario. Le poche situazioni in cui è fortemente indicato cambiare terapia sono, al momento, le “mono” o le “dual”, per l’ipotetica possibilità di fallimento virologico.
I farmaci più consigliati sono quelli su cui c’è più esperienza per i quali non vi sono segnalazioni di tossicità o di mancata efficacia.
Inibitori non nucleosidici della trascrittasi inversa
Gli NNRTI sono stati i più utilizzati in gravidanza per la loro lunga emivita.
Nevirapina (NVP), molto usata con varie modalità (anche limitate al parto) nei paesi in via di sviluppo, è stata via via sostituita a causa delle resistenze e degli effetti collaterali.
Efavirenz (EFV), che per vari anni è stato controindicato per un aumentato rischio di malformazioni del tubo neurale, è stato successivamente utilizzato, senza altre segnalazioni di teratogenicità, soprattutto nei paesi a risorse limitate.
Lo studio che ne aveva evidenziato la teratogenicità è stato condotto su primati e confermato da successivi studi in vivo (PACTG protocols 219 and 219C). Negli anni, però, altri lavori numericamente consistenti, raccolti in un’ampia meta-analisi, non hanno invece dimostrato associazioni significative, tanto che in molte recenti linee guida (americane, WHO, britanniche) EFV viene raccomandato anche nel primo trimestre. Nelle nostre linee guida resta, comunque, l’indicazione a non usarlo nelle prime 6 settimane di gravidanza, ma si consiglia di mantenerlo qualora la paziente si presenti al controllo quando sono già passate le prime 6 settimane.
Rilpivirina (RPV) può essere utilizzata (seguendo le linee guida per i pazienti naive con HIV-RNA<100.000 cp/ml e CD4>200 cell/mmc) sebbene i dati siano comunque limitati.
Inibitori nucleosidici della trascrittasi
Tra gli NRTI è consigliata sia l’associazione tenofovir/ emtricitabina (TDF/FTC), sia abacavir/lamivudina (ABC/3TC), anche se quest’ultima solo se HIV-RNA<100.000 cp/mL e se HLA-B-57 01 assente. La formulazione zidovudina/3TC, utilizzata ampiamente in gravidanza, è raccomandata di seconda scelta a causa dei maggiori effetti collaterali.
Tenofovir alafenamide (TAF), invece non ha ancora disponibili dati specifici, quindi non è consigliato. Questo significa che i nuovi farmaci co-formulati con TAF, come TAF + FTC + RPV e TAF + FTC + EVG + COBI, non hanno al momento questa indicazione.
Inibitori delle proteasi
Il farmaco di questa classe che ha più studi di efficacia e sicurezza è sicuramente il lopinavir/ ritonavir (LPV/r), che è stato lungamente usato in gravidanza, ma che è gravato da effetti collaterali frequenti (nausea e diarrea, dislipidemia), elevato numero di compresse (con aumento nel secondo e terzo trimestre) e somministrazione bis in die. Tutti questi fattori ne hanno limitato l’uso e lo pongono come farmaco alternativo nelle linee guida attuali.
Atazanavir (ATV) e darunavir (DRV) sono entrambi consigliati, anche se presentano alcune interazioni farmacologiche ed effetti collaterali, che vanno considerati. Ad esempio aumentano le concentrazioni, potenziandone gli effetti collaterali, di metilergometrina, utilizzata per indurre la contrazione uterina nel post-partum. ATV non può essere assunto con inibitori di pompa. La concentrazione plasmatica può ridursi nel terzo trimestre e richiedere un aumento del dosaggio. Le linee guida americane richiedono sempre il dosaggio di 600 mg ogni dodici ore per DRV. DRV e ATV, inoltre, sono consigliati solo se il booster è con RTV.
Infatti per quanto riguarda i booster compresi nelle moderne ARV, mentre RTV ha dati consolidati, cobicistat non ha al momento dati specifici. Gli inibitori delle proteasi coformulati con cobicistat come ATV + COBI e DRV + COBI non sono quindi consigliati. In particolare, darunavir 800/cobicistat è stato definito a giugno 2018 come non raccomandato in gravidanza a causa di uno studio di fase 3 (TMC114HIV3015) che ha dimostrato in 6 donne gravide una riduzione di circa il 50% della concentrazione plasmatica nel secondo e terzo trimestre.
Inibitori dell’integrasi
Raltegravir (RAL) è il farmaco più frequentemente raccomandato nelle differenti linee guida per l’assenza di segnalazioni negative e soprattutto per la sua rapidità d’azione, che lo rende il candidato ideale soprattutto per le donne che iniziano la terapia nella gravidanza avanzata. Numerosi studi ne confermano una buona farmacocinetica e un buon profilo di tollerabilità in gravidanza. E’ indicato nella formulazione classica due volte al giorno, in quanto non vi sono dati per la nuova (600x2 OD).
Elvitegravir (ELV), invece, non è consigliato per la sua associazione con cobicistat. Inoltre nello studio multicentrico IMPAACT P1026 sulla farmacocinetica dei farmaci ARV in gravidanza è stato visto che in 30 gravide trattate con ELV + TDF + FTC + COBI, si aveva una riduzione plasmatica di elvitegravir nel secondo e nel terzo trimestre rispettivamente del 24% e del 44%, che potrebbe esporre a possibili fallimenti virologici (8). Per questo, sia TDF + FTC + ELV + COBI, che TAF + FTC + ELV + COBI non sono consigliati: se la donna è già in terapia con questi farmaci ed è a viremia negativa, va monitorata per HIV-RNA con maggiore frequenza nell’ultimo trimestre (andrebbe fatto il dosaggio plasmatico (TDM) delle singole molecole).
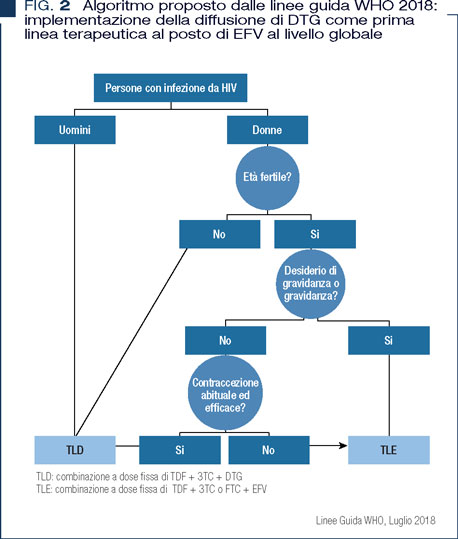 Dolutegravir (DTG) è stato proposto come farmaco ideale in gravidanza per la sua potenza, anche perché la sua formulazione recente “genericata” e coformulata con TDF/3TC (TLD) è disponibile a basso costo nei paesi in via di sviluppo. Si stima che nel mondo circa 500.000 persone sieropositive la stiano assumendo. Infatti, le linee guida WHO di Luglio 2018 la pongono in prima linea come preferred per gli adulti e gli adolescenti (Figura 2) (9). I dati in gravidanza, seppur limitati, provengono dai registri e da studi, alcuni dei quali presentati a congressi e non ancora pubblicati (10). Il Registro internazionale Antiviral Pregnancy Registry (APR) analizzando 142 gravide trattate con DTG non ha mostrato aumento della percentuale di difetti alla nascita rispetto alla popolazione generale, stimata al 3%. Ugualmente, l’European Pregnancy and Paediatric HIV Cohort Collaboration (EPPIC), su 101 gravidanze esposte a DTG non ha evidenziato differenze rispetto agli altri regimi in termini di parti pretermine o basso peso alla nascita. Inoltre i dati di farmacocinetica provenienti dallo studio IMPAACT P1026 in 29 donne hanno evidenziato livelli plasmatici comparabili alla fase pregravidica con un aumento dei livelli in fase post-partum. Il farmaco passa a livello placentare e viene eliminato lentamente nel bambino, proteggendolo dall’infezione al momento del parto (11). Una recente analisi supplementare della coorte Tsepamo Study, richiesta proprio per la preparazione delle linee guida WHO, ha aperto un acceso dibattito. Questa coorte di sorveglianza sulle nascite da madri HIV, è stata istituita nel 2014 in Botswana con finanziamenti NIH/NICHD al fine di evidenziare possibili effetti teratogeni di efavirenz, allora in prima linea nella terapia ARV. Dal 2016, però le linee guida locali sono cambiate e dolutegravir è usato in prima linea come terzo farmaco.
Dolutegravir (DTG) è stato proposto come farmaco ideale in gravidanza per la sua potenza, anche perché la sua formulazione recente “genericata” e coformulata con TDF/3TC (TLD) è disponibile a basso costo nei paesi in via di sviluppo. Si stima che nel mondo circa 500.000 persone sieropositive la stiano assumendo. Infatti, le linee guida WHO di Luglio 2018 la pongono in prima linea come preferred per gli adulti e gli adolescenti (Figura 2) (9). I dati in gravidanza, seppur limitati, provengono dai registri e da studi, alcuni dei quali presentati a congressi e non ancora pubblicati (10). Il Registro internazionale Antiviral Pregnancy Registry (APR) analizzando 142 gravide trattate con DTG non ha mostrato aumento della percentuale di difetti alla nascita rispetto alla popolazione generale, stimata al 3%. Ugualmente, l’European Pregnancy and Paediatric HIV Cohort Collaboration (EPPIC), su 101 gravidanze esposte a DTG non ha evidenziato differenze rispetto agli altri regimi in termini di parti pretermine o basso peso alla nascita. Inoltre i dati di farmacocinetica provenienti dallo studio IMPAACT P1026 in 29 donne hanno evidenziato livelli plasmatici comparabili alla fase pregravidica con un aumento dei livelli in fase post-partum. Il farmaco passa a livello placentare e viene eliminato lentamente nel bambino, proteggendolo dall’infezione al momento del parto (11). Una recente analisi supplementare della coorte Tsepamo Study, richiesta proprio per la preparazione delle linee guida WHO, ha aperto un acceso dibattito. Questa coorte di sorveglianza sulle nascite da madri HIV, è stata istituita nel 2014 in Botswana con finanziamenti NIH/NICHD al fine di evidenziare possibili effetti teratogeni di efavirenz, allora in prima linea nella terapia ARV. Dal 2016, però le linee guida locali sono cambiate e dolutegravir è usato in prima linea come terzo farmaco.
Lo studio di confronto tra EFV e DTG non ha mostrato differenze di outcome tra i due bracci di donne che avevano iniziato la ART in gravidanza, anche nel sottogruppo di 280 donne trattate nel primo trimestre (12).
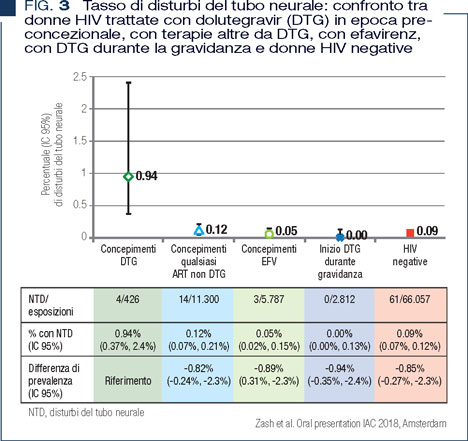 Allo scopo di valutare l’effetto in epoca concezionale, il WHO ha chiesto di analizzare anche le donne che avevano assunto la terapia ARV prima della gravidanza. Tale analisi, presentata all’ultimo IAC, ha mostrato 4 casi di disturbi del tubo neurale in 426 donne nel gruppo DTG verso 14 casi in 11.300 donne che avevano concepito con altra ARV (~0.9% versus 0.1%,) (13) (Figura 3).
Allo scopo di valutare l’effetto in epoca concezionale, il WHO ha chiesto di analizzare anche le donne che avevano assunto la terapia ARV prima della gravidanza. Tale analisi, presentata all’ultimo IAC, ha mostrato 4 casi di disturbi del tubo neurale in 426 donne nel gruppo DTG verso 14 casi in 11.300 donne che avevano concepito con altra ARV (~0.9% versus 0.1%,) (13) (Figura 3).
Tali dati sono stati subito recepiti dallo stesso WHO, dall’FDA, dall’Agenzia Europea del Farmaco (EMA) e dal DHHS che hanno inviato nuove indicazioni per non iniziare DTG nelle donne che desiderano un figlio fino a 8 settimane dall’ultima mestruazione o nel primo trimestre. Nelle donne già in terapia con DTG e in gravidanza si suggerisce lo switch ad altra terapia efficace, se disponibile, solo nelle prime 8 settimane/ primo trimestre.
A marzo 2019 lo studio Tsepamo fornirà ulteriori dati che potranno chiarire meglio questo potenziale rischio del farmaco.
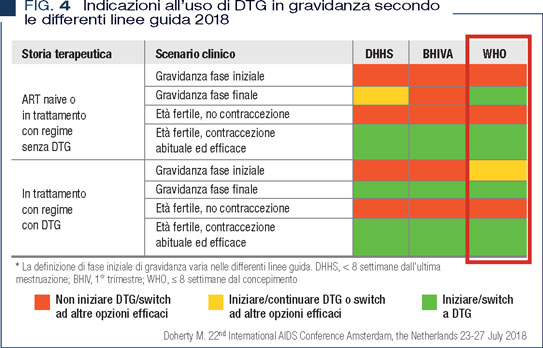 La questione è sotto attenta osservazione e, dalla prima segnalazione, è iniziata una raccolta allargata di dati relativi al problema della sicurezza di questa classe di farmaci di largo impiego per chiarire rapidamente il rischio del loro uso in gravidanza. Alcuni dati e pareri di esperti suggeriscono in ogni caso di valutare sempre la condizione viroimmunologica della donna in quanto se DTG è l’unica terapia possibile è preferibile continuarla, discutendo con la donna potenziali rischi e sicuri benefici (Figura 4) (14). Nelle linee guida WHO viene promosso un woman-centred approach, che veda la donna informata correttamente in grado di decidere sulla sua salute.
La questione è sotto attenta osservazione e, dalla prima segnalazione, è iniziata una raccolta allargata di dati relativi al problema della sicurezza di questa classe di farmaci di largo impiego per chiarire rapidamente il rischio del loro uso in gravidanza. Alcuni dati e pareri di esperti suggeriscono in ogni caso di valutare sempre la condizione viroimmunologica della donna in quanto se DTG è l’unica terapia possibile è preferibile continuarla, discutendo con la donna potenziali rischi e sicuri benefici (Figura 4) (14). Nelle linee guida WHO viene promosso un woman-centred approach, che veda la donna informata correttamente in grado di decidere sulla sua salute.
In conclusione, possiamo affermare che tutti gli studi riguardanti i farmaci ARV in gravidanza vanno incentivati, perché rappresentano il punto più importante nella prevenzione della trasmissione materno fetale e il loro utilizzo al livello globale sta determinando una netta riduzione del numero di bambini HIV infetti, favorendo in generale la salute della donna.
Bibliografia
- Connor EM, Sperling RS, Gelber R, et al. Reduction of maternal-infant transmission of HIV-1 with zidovudine treatment. PACTG 076. N Engl J Med. 1994; 331:1173-1180.
- Linee Guida Italiane sull’utilizzo della Terapia Antiretrovirale e la gestione diagnostico-clinica delle persone con infezione da HIV-1 Edizione 2017. Disponibile su: www.salute.gov.it e www.simit.org.
- Panel on Treatment of Pregnant Women with HIV Infection and Prevention of Perinatal Transmission. Recommendations for Use of Antiretroviral Drugs in Transmission in the United States, Nov 2017. Available at http://aidsinfo.nih.gov/contentfiles/lvguidelines/ PerinatalGL.pdf
- British HIV Association guidelines for the management of HIV infection in pregnant women, 2018.
- Health FOoP. Maladies transmissibles: Recommandations de la Commission fédérale pour la santé sexuelle (CFSS) en matière de prévention contre la transmission du VIH de la mère à l’enfant. Bulletin 04/16. Bulletin 4/16 ed. Vol 2017. Switzerland, 2016
- Mandelbrot L, Tubiana R, Le Chenadec J, et al. No Perinatal HIV-1 Transmission From Women With Effective Antiretroviral Therapy Starting Before Conception. Clin Infect Dis 2015; 61:1715-1725.
- Neubert J, Pfeffer M, Borkhardt A, et al. Risk adapted transmission prophylaxis to prevent vertical HIV-1 transmission: effectiveness and safety of an abbreviated regimen of postnatal oral zidovudine. BMC Pregnancy Childbirth 2013; 13:22.
- Momper JD, Best BM, Wang J, et al. IMPAACT P1026s Protocol Team. Elvitegravir/cobicistat pharmacokinetics in pregnant and postpartum women with HIV. AIDS. 2018 Aug 20.
- WHO updated recommendations on first-line and second-line antiretroviral regimens and post-exposure prophylaxis and recommendations on early infant diagnosis of HIV. Luglio 2018. Disponibile su: www.who.int/hiv/pub/guidelines/ARV2018update/en/
- Hill A, Clayden P, Thorne C, et al. Safety and pharmacokinetics of dolutegravir in HIV-positive pregnant women: a systematic review. Virus Erad. 2018; 4(2):66-71.
- Mulligan N, Best BM, Wang J, et al. IMPAACT P1026s Protocol Team. Dolutegravir pharmacokinetics in pregnant and postpartum women living with HIV. AIDS. 2018 Mar 27;32(6):729-737.
- Zash R, Jacobson DL, Diseko M, et al. Comparative safety of dolutegravir-based or efavirenz-based antiretroviral treatment started during pregnancy in Botswana: an observational study. Lancet Glob Health. 2018; 6(7):e804-e810.
- Zash R, Holmes L, Makhema J, et al. Surveillance for Neural Tube Defects following Antiretroviral Exposure from Conception. Oral presentation 22nd International AIDS Conference | Amsterdam, the Netherlands | 23-27 July 2018.
- Recommendations Regarding the Use of Dolutegravir in Adults and Adolescents with HIV who are Pregnant or of Child-Bearing Potential. AIDS info 30 maggio 2018. Disponibile su: aidsinfo.nih.gov.






