L’epatite autoimmune (EAI) è una infiammazione cronica del fegato che si sviluppa in soggetti geneticamente predisposti come risultato dell’esposizione ad un evento scatenante che per la maggior parte dei casi rimane non identificato. Sono stati indicati come possibili fattori scatenanti i virus epatotropi (virus del morbillo, EBV, i virus dell’epatite A, B e C), i tossici ambientali, i farmaci e le vaccinazioni (1). Il tempo che intercorre fra l’esposizione all’evento scatenante e la comparsa dei sintomi può essere molto variabile (2). Le evidenze più forti di associazione fra infezioni con virus epatotropi ed EAI sono a carico dell’infezione da HAV (3) o della corrispondente vaccinazione (4).
La comparsa di reazioni autoimmuni dopo una vaccinazione di qualunque natura rimane comunque rara ed è stimata attorno allo 0.01%. La maggior parte di queste reazioni descritte in letteratura sono di lieve entità e tendono alla risoluzione spontanea (5). Numerosi meccanismi sono stati chiamati in causa per spiegare la comparsa post-vaccinale di malattie autoimmuni. Fra questi il mimetismo molecolare fra determinanti antigenici del vaccino che contengono sequenze di aminoacidi simili ad antigeni self ed in grado di stimolare la produzione di autoanticorpi e l’attivazione di cellule T autoreattive.
Inoltre i vaccini sono in grado di amplificare i meccanismi di autoimmunità mediante il rilascio di numerose citochine a seguito di un’imponente stimolazione della immunità innata, che nei vaccini di vecchia generazione è solitamente stimolata dalla presenza di adiuvanti fra i componenti del vaccino. Nel caso della maggior parte dei vaccini sviluppati contro SARS-CoV-2, l’attivazione dei segnali proinfiammatori comprensivi dell’IFN di tipo 1 è mediata dal riconoscimento diretto dell’mRNA o del dsDNA da parte dei toll-like receptor nelle cellule dendritiche (6).
Revisione dei casi descritti in letteratura
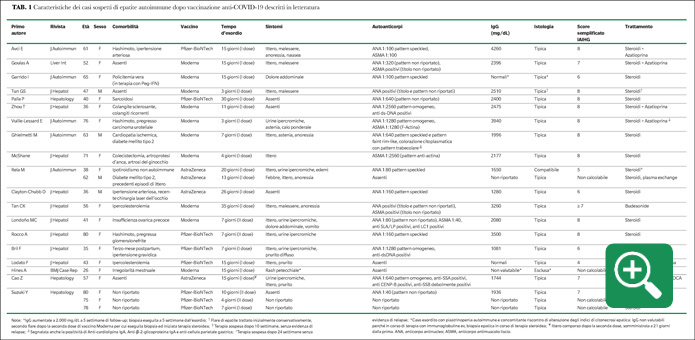
La ricerca è stata eseguita utilizzando come motore di ricerca PubMed, inserendo come parole chiave “COVID vaccine”, “SARS-CoV-2 vaccine” e “Autoimmune hepatitis”. Sono stati identificati un totale di 19 report, riguardanti un totale di 22 casi di sospetta epatite autoimmune secondaria a vaccinazione anti-COVID-19. Le principali caratteristiche cliniche e immunologiche sono presentate nella Tabella 1.
L’età mediana del campione identificato è 57 anni (IQR 40-70), con una netta prevalenza del sesso femminile (18/22, 82%). Tra le comorbilità più rilevanti segnaliamo la tiroidite di Hashimoto (3/22, 14%) e, in generale, malattie immunomediate (5/22, 23%). I vaccini più coinvolti nelle segnalazioni sono quelli che sfruttano la metodica a mRNA, rispettivamente Moderna nel 46% (10/22) e Pfizer-BioNTech nel 36% (8/22), mentre Astra-Zeneca è coinvolto nel 18% delle segnalazioni (4/22). Per quanto difficilmente standardizzabile, il tempo d’esordio è generalmente abbastanza breve in tutte le segnalazioni, con mediana di 12 giorni (IQR 7-15). L’82% dei casi (18/22) è insorto dopo la prima dose del ciclo vaccinale. In oltre la metà dei casi (13/22, 60%) il paziente ha presentato una forma di epatite acuta itterica, più o meno associata ad altri sintomi.
Dal punto di vista immunologico, è segnalata la presenza di autoanticorpi utili per la diagnosi di EAI nel 77% dei casi (17/22), di cui ANA in 15 pazienti (95%), con una positività per anti ds-DNA in due casi su 15, ASMA in 5 casi (30%), SLA/LP in un unico caso (6%). Nel 14% dei casi (3/22) la sierologia è risultata negativa, mentre in due casi non viene riportata. I valori di immunoglobuline G sono aumentati nel 64% delle segnalazioni (14/22). L’esame istologico, sebbene non dirimente, è risultato suggestivo per epatite autoimmune nel 95% dei casi (21/22). In tutti i casi segnalati in letteratura il trattamento ha previsto l’utilizzo di steroide a dosi medio-alte eventualmente associato ad azatioprina, tranne un caso trattato con budesonide. L’andamento clinico è stato favorevole nella quasi totalità dei casi e in due casi viene segnalata la sospensione della terapia immunosoppressiva senza ripresa del danno epatocitario. L’unico caso evoluto verso una condizione di acute liver failure e successivo decesso è stato un paziente maschio, con probabile epatopatia di base misconosciuta, vaccinato con Astra-Zeneca (Rela M).
Discussione
Con l’avvio della campagna mondiale di vaccinazioni nei confronti dell’infezione da SARS-CoV-2 sono stati segnalati diversi casi di danno epatico secondario alla vaccinazione. Questo danno epatico si caratterizza di frequente per un fenotipo clinico laboratoristico suggestivo per EAI. Nella Tabella 1 sono elencati i casi a tutt’oggi segnalati in letteratura in cui è suggerito un nesso di relazione causale fra la vaccinazione per COVID-19 e la diagnosi di EAI. Si tratta di un gruppo di pazienti raccolti retrospettivamente in modo osservazionale molto eterogenei fra di loro, vaccinati prevalentemente, ma non esclusivamente, con vaccini a mRNA.
La modalità di esordio del danno epatico segnalata nei vari report è eterogenea, compresa fra un’epatite acuta itterica associata a sintomi prodromici aspecifici e il riscontro casuale di ipertransaminasemia asintomatica in corso di accertamenti di routine. In alcuni casi il nesso causale con la vaccinazione è stato giudicato debole dalla discussione scientifica scaturita in letteratura (Bril F, Zhou T). Tuttavia, in un unico caso segnalato da Tun GS è provato inequivocabilmente il nesso causale tra vaccinazione con Moderna e danno epatico, attraverso il rechallange con la seconda dose a distanza di due mesi, che risulta indurre un flare epatitico del tutto analogo a quello riscontrato dopo la prima.
In generale, le caratteristiche del danno epatico hanno un'evidente impronta autoimmune, tanto che nella maggior parte dei casi lo score semplificato IAIHG è uguale o superiore a 7.
Il fatto che questo tipo di reazione avversa sia riportata sia con vaccini a mRNA, quali Moderna e Pfizer-BioNTech, che con vaccini a dsDNA con vettore adenovirale, come Astra-Zeneca, suggerisce l’idea che questi siano in grado di attivare fenomeni autoimmuni indipendentemente dal loro meccanismo di azione. È dimostrato che entrambe le formulazioni vaccinali inducano alti livelli di sintesi di proteina S all’interno delle cellule dendritiche a livello del sito di iniezione e linfonodale, e che entrambe le formulazioni convergono sulla produzione di IFN di tipo I, da un lato stimolata dai toll-like receptor 7 (TLR7) e MDA5 per i vaccini a mRNA e dall’altro dai toll-like receptor 9 (TLR9) per i vaccini a dsDNA (7).
I principali meccanismi di danno epatocitario ipotizzati sono due. In prima istanza risulta verosimile che l’iperproduzione di IFN di tipo I e altre citochine pro-infiammatorie possa indurre l’attivazione di cloni di cellule T-helper quiescenti che esplicano un danno epatico con il fenotipo autoimmune. Dall’altro lato è possibile ipotizzare che gli anticorpi e i linfociti T effettori generati contro la proteina Spike possano indurre danno epatocitario diretto attraverso un meccanismo di mimetismo molecolare. A supporto di questa ipotesi è dimostrato che gli anticorpi prodotti contro la proteina Spike in corso di infezione naturale da COVID-19 sono in grado di cross-reagire con numerose proteine dell’organismo ospite (8) e che gli anticorpi indotti dalla vaccinazione sono analoghi a questi (9). Seppur questo meccanismo non sia escludibile, ad oggi non è stata dimostrata un’analogia tra sequenze amminoacidiche della proteina Spike con determinanti antigenici specifici dell’epatocita.
Dall’analisi dei casi riportati nella tabella sorgono numerose domande. Si tratta di casi tipici di EAI attivata dalla vaccinazione oppure la vaccinazione ha suscitato un drug induced liver injury (DILI) con fenotipo autoimmune? Non sono al momento ancora disponibili tutte le informazioni utili per potere differenziare fra le due condizioni. La DILI con fenotipo autoimmune risponde infatti allo steroide allo stesso modo dell’epatite autoimmune primitiva. Solo il follow-up è in grado di differenziare fra le due patologie: nel caso della DILI con fenotipo autoimmune lo steroide può essere sospeso senza rischio di riattivazione della malattia mentre nell’epatite autoimmune primitiva la riattivazione alla sospensione dello steroide è pressoché universale se avviene solo dopo qualche mese dall’esordio di malattia. In due dei casi è riportata la sospensione della terapia steroidea dopo un periodo di tempo variabile di osservazione (da 1 a 4 mesi) senza il riscontro di una ripresa di malattia (Rela M, Vuille-Lessard E). Queste segnalazioni, seppure limitate come numero, suggeriscono che i casi descritti rappresentino una DILI con fenotipo autoimmune più che un’EAI primitiva. Un tentativo di riduzione dello steroide fino alla sospensione rappresenta quindi uno strumento utile nei casi dubbi come elemento di diagnosi differenziale.
Rimane aperta la domanda se i soggetti che hanno sviluppato un danno epatico che ha richiesto la necessità di instaurare una terapia immunosoppressiva possano ricevere il secondo o terzo richiamo, che potrebbe complicarsi con un flare epatitico clinicamente rilevante. Allo stesso modo, dovremmo chiederci quale sia la strategia di vigilanza più utile per individuare questo tipo di complicanza, tenendo in considerazione che è probabile che decorra in maniera pauci/asintomatica in una quota significativa di casi. Un controllo delle transaminasi a 2-4 settimane dalla vaccinazione potrebbe rappresentare una misura con rapporto costo/beneficio favorevole, soprattutto nella popolazione più a rischio, come le donne tra i 40-80 anni di età, o in pazienti con anamnesi positiva per malattia autoimmune o epatopatia.
- Castiella A, Zapada E, Lucerna MI, et al. Drug-induced autoimmune liver disease: a diagnostic dilemma of an increasingly reported disease. Wold J Hepatol. 2014; 6:160-168.
- Perumalswami P, Peng L, Odin JA. Vaccination as a triggering event for autoimmune hepatitis. Semin Liver Dis. 2009; 29:331-334.
- Singh G, Palaniappan S, Rotimi O, et al. Autoimmune hepatitis triggered by hepatitis A. Gut. 2007; 56:304.
- van Gemeren MAJ, van Wijagaarden P, Doukas M, et al. Vaccine-related autoimmune hepatitis: the same disease as idiopathic autoimmune hepatitis? Two clinical reports and review. Scand J Gastroenterol. 2017; 52:18-22.
- Soriano A, Nesher G, Shoenfeld Y. Predicting post-vaccination autoimmunity: who might be at risk? Pharmacol Res. 2015; 92:18-22.
- Salemi S, D’Amelio R. Could autoimmunity be induced by vaccination? Int Rev Immunol. 2010; 29:247-269.
- Teijaro JR, Farber DL. COVID-19 vaccines: modes of immune activation and future challenges. Nat Rev Immunol. 2021; 21:195-197.
- Vojdani A, Kharrazian D. Potential antigenic cross-reactivity and human tissue with possible link to an increase in autoimmune diseases. Clinical Immunol. 2020; 217:108480.
- Talotta R. Do COVID-19 RNA-based vaccines put a risk of immune-mediated disease? Clinical Immunol. 2021; 224:108665.