La definizione negli anni 1980 della struttura molecolare del virus dell’epatite D (HDV) ha suscitato il dilemma relativo a come replichi il virus, essendo il suo genoma costituito da una catena circolare di RNA che contiene solo circa 1.700 nucleotidi (1).
Per le sue dimensioni, l’HDV è più piccolo di ogni altro virus umano; codifica per una corta proteina antigenica che viene espressa in due isoforme, l’antigene HD piccolo (small HD) e l’antigene HD grande (large HDAg), ma non possiede capacità di replicazione autonoma in quanto il genoma è così minuto da non poter codificare per corposi enzimi replicativi propri, come le proteasi e le polimerasi virus-indotte che inducono la replicazione dell’HBV e dell’HCV.
L’enigma della replicazione è stato risolto negli anni ‘90 dall’accertamento nell’HDV di un singolare meccanismo di replicazione a rolling circle (circolo rotante), e del ruolo cruciale dell’HBsAg nel suo ciclo vitale, per cui l’HDV si qualifica come un virus difettivo dipendente dall’HBV.
La trasmissione via infezione de novo
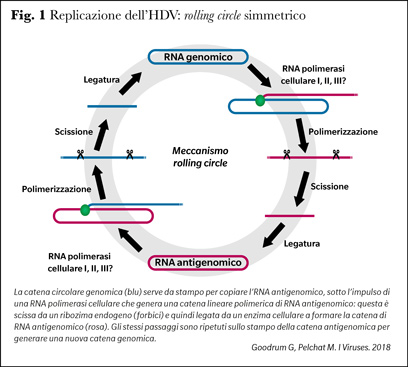 L’HDV entra nell’epatocita attraverso il polipeptide co-trasportatore del taurocolato di sodio (NTCP). Dopo lo smantellamento della particella virale, il genoma è trasportato nel nucleo in cui replica via un doppio meccanismo simmetrico a rolling circle (1,2). Il primo passo nella replicazione è lo srotolamento sul genoma circolare di una catena lineare multimerica di RNA complementare, l’antigenoma. Il polimero antigenomico viene tagliato in monomeri lineari di RNA virale, che vengono quindi legati in forme antigenomiche circolari; esse fungono a loro volta da stampo su cui si srotola e viene ricomposto il genoma infettivo. Nella replicazione è cruciale il ruolo di un ribozima, cioè di un segmento di circa 100 nucleotidi presente nell’antigenoma e nel genoma, capace di scindere i multimeri di RNA in monomeri e poi di ricomporli in RNA circolare infettivo senza l’intervento di una funzione enzimatica (Figura 1).
L’HDV entra nell’epatocita attraverso il polipeptide co-trasportatore del taurocolato di sodio (NTCP). Dopo lo smantellamento della particella virale, il genoma è trasportato nel nucleo in cui replica via un doppio meccanismo simmetrico a rolling circle (1,2). Il primo passo nella replicazione è lo srotolamento sul genoma circolare di una catena lineare multimerica di RNA complementare, l’antigenoma. Il polimero antigenomico viene tagliato in monomeri lineari di RNA virale, che vengono quindi legati in forme antigenomiche circolari; esse fungono a loro volta da stampo su cui si srotola e viene ricomposto il genoma infettivo. Nella replicazione è cruciale il ruolo di un ribozima, cioè di un segmento di circa 100 nucleotidi presente nell’antigenoma e nel genoma, capace di scindere i multimeri di RNA in monomeri e poi di ricomporli in RNA circolare infettivo senza l’intervento di una funzione enzimatica (Figura 1).
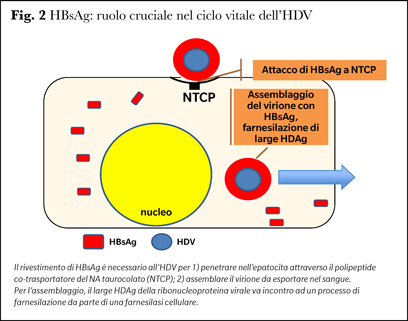 Il caposaldo della replicazione è un meccanismo anomalo; l’impulso replicativo non è indotto dal virus ma dalle RNA polimerasi cellulari ingannate e ridirette a replicare direttamente l’RNA virale invece che ad accettare, come di regola, il DNA per trascriverlo in RNA (3). Ne deriva che l’HDV non è suscettibile all’attacco degli antivirali convenzionali (anti proteasi ed anti polimerasi). Esso è parimenti incapace di codificare per proteine proprie di rivestimento e sfrutta l’HBsAg fornitogli dall’HBV per costituirsi nella particella infettiva che penetra ed esce dagli epatociti (Figura 2) (4); nell’assemblaggio del virione, l’HD large della ribonucleoproteina virale migrata dal nucleo nel citoplasma subisce un processo di farnesilazione da parte di farnesil transferasi cellulari (5). Le attuali conoscenze sulla replicazione “convenzionale” dell’HDV sono riassunte nella revisione della dottoressa Lucifora (6).
Il caposaldo della replicazione è un meccanismo anomalo; l’impulso replicativo non è indotto dal virus ma dalle RNA polimerasi cellulari ingannate e ridirette a replicare direttamente l’RNA virale invece che ad accettare, come di regola, il DNA per trascriverlo in RNA (3). Ne deriva che l’HDV non è suscettibile all’attacco degli antivirali convenzionali (anti proteasi ed anti polimerasi). Esso è parimenti incapace di codificare per proteine proprie di rivestimento e sfrutta l’HBsAg fornitogli dall’HBV per costituirsi nella particella infettiva che penetra ed esce dagli epatociti (Figura 2) (4); nell’assemblaggio del virione, l’HD large della ribonucleoproteina virale migrata dal nucleo nel citoplasma subisce un processo di farnesilazione da parte di farnesil transferasi cellulari (5). Le attuali conoscenze sulla replicazione “convenzionale” dell’HDV sono riassunte nella revisione della dottoressa Lucifora (6).
Gli studi degli ultimi due decenni del secolo scorso hanno dunque ben definito il meccanismo di infezione de novo dell’HDV; pur attraverso una modalità di replicazione unica in virologia umana e pur rivestendosi nel capside di un virus diverso, esso segue il classico percorso della formazione intracellulare di un virione maturo che viene esportato nel sangue ad infettare nuovi epatociti.
La trasmissione per divisione cellulare
Studi di ricercatori tedeschi che fanno capo al dottor Stephan Urban hanno dimostrato che l’infezione de novo non è l’unico meccanismo con cui trasmette l’HDV ma che esso trasmette da epatocita ad epatocita anche attraverso divisione cellulare diretta, indipendentemente dalla presenza dell’HBsAg (7); un meccanismo di trasmissione diretta è ignoto nei virus animali ma è stato rilevato nei viroidi delle famiglie degli Endornaviridae, Totiviridae o Crysoviridae, che trasmettono e diffondono solo attraverso divisione cellulare (8).
La sorpresa è venuta da studi sperimentali in due sistemi cellulari elaborati per studiare il ciclo dell’HDV e le sue interazioni con gli epatociti umani:
- cellule di epatomi transdotti con il polipeptide co-trasporatore del sodio taurocolato che rappresenta il recettore per l’HBsAg (cellule HuH7 NTCP), infettate con HDV. Nelle culture cellulari è stato aggiunto il Myrcludex, farmaco che blocca l’entrata dell’HBsAg negli epatociti (9)
- topi USB umanizzati, trapiantati con epatociti umani positivi per HDV, modello che consente agli epatociti umani infetti dai virus di proliferare nel fegato rigenerante dei topi. Myrcludex è stato somministrato sottocute ad un gruppo di topi a giorni alterni per 2-8 settimane dopo il trapianto.
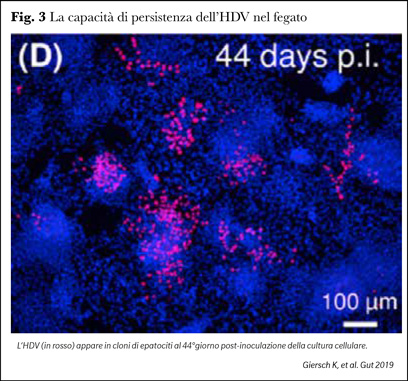 Sia l’esperimento in vitro che quello in vivo, con e senza Myrcludex, hanno dimostrato che HDV RNA viene trasmesso durante la divisione epatocitaria in assenza dell’HBV. Nelle culture cellulari l’HDV RNA genomico ed antigenomico, come l’antigene HD, sono stati ben determinabili fino al nono passaggio seriale corrispondente al 65° giorno post-inoculazione, per rimanere poi misurabili con intensità decrescente fino al 100° giorno. Parimenti, l’HDV è stato trasmesso con divisione cellulare nel modello in vivo nei topi USB trapiantati con epatociti umani HDV positivi; gli epatociti HDV infetti sono proliferati nel fegato rigenerante dei topi fino ad 8 settimane dopo il trapianto formando dei cloni cellulari (Figura 3). La trasmissione dell’HDV per divisione cellulare diretta spiega come, nell’ambito del trapianto epatico in pazienti HDV positivi, il virus recidivo è persistito nel fegato fino a 19 mesi post-trapianto senza evidenza di coinfezione con l’HBV (10,11).
Sia l’esperimento in vitro che quello in vivo, con e senza Myrcludex, hanno dimostrato che HDV RNA viene trasmesso durante la divisione epatocitaria in assenza dell’HBV. Nelle culture cellulari l’HDV RNA genomico ed antigenomico, come l’antigene HD, sono stati ben determinabili fino al nono passaggio seriale corrispondente al 65° giorno post-inoculazione, per rimanere poi misurabili con intensità decrescente fino al 100° giorno. Parimenti, l’HDV è stato trasmesso con divisione cellulare nel modello in vivo nei topi USB trapiantati con epatociti umani HDV positivi; gli epatociti HDV infetti sono proliferati nel fegato rigenerante dei topi fino ad 8 settimane dopo il trapianto formando dei cloni cellulari (Figura 3). La trasmissione dell’HDV per divisione cellulare diretta spiega come, nell’ambito del trapianto epatico in pazienti HDV positivi, il virus recidivo è persistito nel fegato fino a 19 mesi post-trapianto senza evidenza di coinfezione con l’HBV (10,11).
In un successivo studio dei virologi tedeschi (12), la disponibilità di culture cellulari per studiare la replicazione dell’HDV ha permesso di dimostrare un ruolo importante dell’interferone nel sopprimere la diffusione virale attraverso la divisione cellulare. Il nuovo studio ha confrontato la disseminazione dell’HDV per divisione cellulare in risposta all’interferone (IFN) endogeno ed all’IFN esogeno in due linee cellulari epatiche, HuH7 NTCP e HepaRG NTCP. Nei due sistemi cellulari la produzione spontanea e l’effetto dell’IFN sono diversi; i primi sono carenti nella sintesi della citochina seppur riescono ad attivare la cascata dei segnali interferonici se trattati con IFN esogeno, i secondi sono spontaneamente competenti nella produzione della citochina e nel rispondere all’allerta degli induttori della sua attivazione.
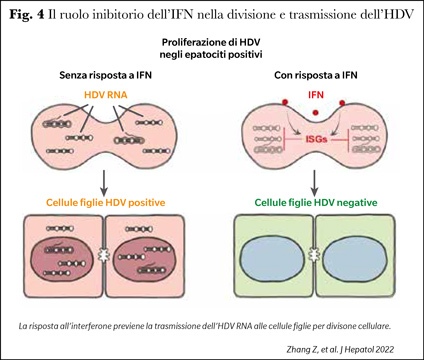 I risultati dello studio hanno evidenziato che la disseminazione dell’HDV con la divisione cellulare è efficiente dopo infezione delle cellule HuH7 NTCP (difettive nella produzione di IFN) ma è ridotta nelle cellule HepaRG NTCP IFN competenti; nondimeno il blocco della risposta interferonica indotta con l’inibitore JAK1/2 ruxolitinib o la soppressione dell’attività inducente del gene MDA5, ha considerevolmente aumentato la disseminazione dell’HDV anche nelle cellule HepaRG NTCP in divisione (Figura 4).
I risultati dello studio hanno evidenziato che la disseminazione dell’HDV con la divisione cellulare è efficiente dopo infezione delle cellule HuH7 NTCP (difettive nella produzione di IFN) ma è ridotta nelle cellule HepaRG NTCP IFN competenti; nondimeno il blocco della risposta interferonica indotta con l’inibitore JAK1/2 ruxolitinib o la soppressione dell’attività inducente del gene MDA5, ha considerevolmente aumentato la disseminazione dell’HDV anche nelle cellule HepaRG NTCP in divisione (Figura 4).
Il ruolo inibitorio dell’IFN nella divisione e trasmissione dell’HDV implica un’importante ricaduta terapeutica. La terapia dell’epatite cronica D s’è finora basata sulla somministrazione dell’IFN alfa convenzionale o peghilato.
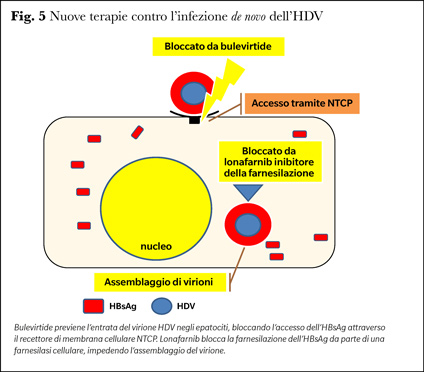 I risultati sono limitati, non più del 30% dei pazienti trattati risponde alla terapia con l’apparente eliminazione dell’HDV RNA ma questo risultato è fittizio; dopo la terapia, la viremia recidiva in oltre il 50% dei pazienti (13). Poiché l’HDV è insensibile agli antivirali diretti, le attuali strategie terapeutiche non sono dirette ad impedirne la sintesi, ma ad impedirne la trasmissione da cellula a cellula, interferendo nel legame del virus con l’HBsAg. I due farmaci ora proposti ed in studio per trattare l’epatite cronica D sono bulevirtide e lonafarnib che inibiscono l’infezione de novo, il primo, bloccando l’entrata nell’epatocita dell’HBsAg che riveste il virione, il secondo, ostacolandone la combinazione con la ribonucleoproteina virale a formare il virione (Figura 5): tuttavia il risultato terapeutico è parziale ed entrambi non interferiscono sulla divisione cellulare.
I risultati sono limitati, non più del 30% dei pazienti trattati risponde alla terapia con l’apparente eliminazione dell’HDV RNA ma questo risultato è fittizio; dopo la terapia, la viremia recidiva in oltre il 50% dei pazienti (13). Poiché l’HDV è insensibile agli antivirali diretti, le attuali strategie terapeutiche non sono dirette ad impedirne la sintesi, ma ad impedirne la trasmissione da cellula a cellula, interferendo nel legame del virus con l’HBsAg. I due farmaci ora proposti ed in studio per trattare l’epatite cronica D sono bulevirtide e lonafarnib che inibiscono l’infezione de novo, il primo, bloccando l’entrata nell’epatocita dell’HBsAg che riveste il virione, il secondo, ostacolandone la combinazione con la ribonucleoproteina virale a formare il virione (Figura 5): tuttavia il risultato terapeutico è parziale ed entrambi non interferiscono sulla divisione cellulare.
L’evidenza di un meccanismo di disseminazione per divisione cellulare e dell’efficacia dell’IFN nel sopprimerlo implica che verosimilmente sia bulevirtide che lonafarnib non saranno comunque sufficienti ad eradicare l’HDV RNA, ma che per l’eliminazione del virus sarà necessaria la combinazione dei due farmaci con l’IFN in modo da sopprimere sia la trasmissione de novo che quella diretta del virus.
Recenti studi hanno di fatto risuscitato il ruolo dell’IFN, indicando un deciso effetto sinergistico della sua combinazione con bulevirtide e lonafarnib nell’indurre una più rapida e più marcata riduzione del titolo dell’HDV RNA sierico (14,15).
- Taylor JM. Infection by Hepatitis Delta Virus. Viruses. 2020;12:648.
- Rizzetto M, Smedile A, Ciancio A. Hepatitis, D. Clinical Virology, 4th ed.; Richman DD, Whitley RJ, Hayden FG, Eds.; ASM Press: Washington, DC, USA, 2017; pp. 1409-1423.
- Chang J, Nie, X, Chang HE, et al. Transcription of hepatitis delta virus RNA by RNA polymerase II. J. Virol. 2008;82:1118-27.
- Urban S, Bartenschlager R, Kubitz R, Zoulim F. Strategies to inhibit entry of HBV and HDV into hepatocytes. Gastroenterology. 2014;147:48-64.
- Goodrum G, Pelchat M. Insight into the Contribution and Disruption of Host Processes during HDV Replication. Viruses. 2018;11:21.
- Lucifora J, Delphin M. Current knowledge on hepatitis delta virus replication. Antivir Res. 2020;179:104812.
- Giersch K, Bhadra OD, Volz T, et al. Hepatitis delta virus persists during liver regeneration and is amplified through cell division both in vitro and in vivo. Gut. 2019;68:150-157.
- Liu H, Fu Y, Xie J, et al. Discovery of novel dsRNA viral sequences by in silico cloning and implications for viral diversity, host range and evolution. PLoS One. 2012;7:e42147.
- Volz T, Allweiss L, Barek M, et al. The entry inhibitor Myrcludex B efficiently blocks intrahepatic virus spreading in humanized mice previously infected with hepatitis B virus. J Hepatol.2013;58:861-7.
- Mederacke I, Filmann N, Yurdaydin C, et al. Rapid early HDV RNA decline in the peripheral blood but prolonged intrahepatic hepatitis delta antigen persistence after liver transplantation. J Hepatol. 2012;56:115-22.
- Samuel D, Zignego AL, Reynes M, et al. Long term clinical and virological outcome after liver transplantation for cirrhosis caused by chronic delta hepatitis. Hepatology. 1995;21:333-9.
- Zhang Z, Ni Y, Lempp FA, et al. Hepatitis D virus induced interferon response and administered interferons control cell division mediated virus spread. J Hepatol. 2022;77:957 966.
- Heidrich B, Yurdaydın C, Kabaçam G, et al. Late HDV RNA relapse after peginterferon alpha based therapy of chronic hepatitis delta. Hepatology. 2014;60:87e97.
- Lampertico P, Roulot D, Wedemeyer H. Bulevirtide with or without pegIFNα for patients with compensated chronic hepatitis delta: From clinical trials to real world studies. J Hepatol. 2022;77:1422-1430.
- Riveiro Barciela M, Palom A, Buti M. Editorial: pegylated interferon combined with bulevirtide for chronic hepatitis delta new life for an old timer? Aliment Pharmacol Ther. 2022;56:912-913.






