La febbre gialla è una infezione virale epatotropa in paesi tropicali, che tuttavia rimane un rischio contemporaneo per il numero crescente di viaggiatori che si recano in aree endemiche per turismo, lavoro o impegni sociali e militari.
Epidemiologia
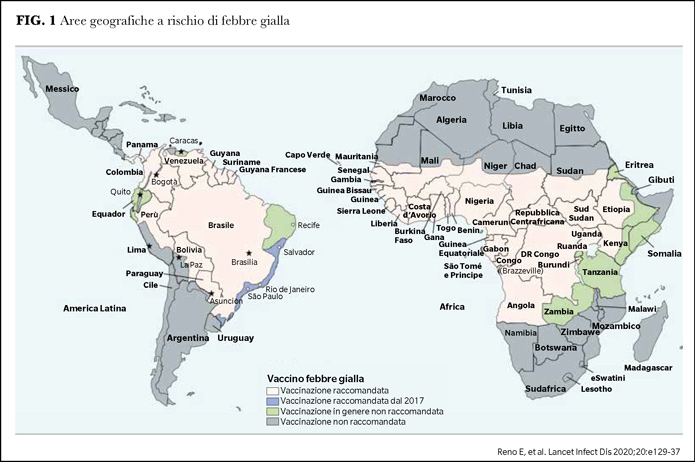
L’infezione è presente in aree dell’Africa e dell’America Centrale e Meridionale, dove è stata importata 400 anni fa dall’Africa con la tratta degli schiavi (Figura 1). L’Asia ne è esente (1).
Si stima che l’incidenza globale dei casi di malattia ammonti a 200.000 per anno con 30.000 decessi e che il rischio dei viaggiatori non vaccinati di infezione per un soggiorno di 2 settimane in aree endemiche sia 50/100.000 in Africa e 5/100.000 in Sud America (2).
Seppur il numero di infezioni è più alto in Africa, in Sud America la mortalità nei casi sintomatici raggiunge il 40-60% in confronto al 20% nell’Africa (3): la minore mortalità in Africa è probabilmente dovuta a fattori genetici selezionati dalla più lunga coevoluzione del virus e dell’ospite.
Infezione e malattia
L’infezione è causata dal virus della febbre gialla, un membro del genus flavivirus a catena singola di RNA, che è trasmesso da artropodi e da insetti (1). Nell’uomo è trasmesso da punture di zanzare che si sono nutrite del sangue di scimmie viremiche (febbre gialla della giungla) e per trasmissione interumana, mediata soprattutto dalla zanzara Aedes aegypti, una specie che si riproduce in polle acquifere nelle abitazioni o nelle loro vicinanze (febbre gialla urbana) (4,5). L’infezione prevale in aree boschive ma vi sono state epidemie urbane importanti. Nel 2015-16 un’epidemia originata in Angola e poi diffusa in Congo ed Uganda ha causato 4.000 casi e 375 morti e nel 2000 un’epidemia nelle aree costiere degli stati di San Paolo, Minas Gerais e Rio de Janeiro in Brasile ha causato 2.000 casi e 680 morti (6).
L’infezione s’accompagna ad uno spettro di manifestazioni cliniche che vanno dai sintomi di una virosi non specifica alla febbre emorragica con scompenso epatico e morte; il rapporto fra infezioni importanti e quelle paucisintomatiche varia da 1:7 a 1:12 (7,8).
Dopo l’inoculazione percutanea il virus viene drenato dai linfonodi donde diffonde in vari tessuti (fegato, miocardio, rene, milza, endotelio) in cui mantiene la propria replicazione. Caratteristico nelle forme gravi è l’impegno epatico massivo; il meccanismo di danno epatocitario, derivato soprattutto dal modello animale, consiste in apoptosi mediozonale e in steatosi, mentre la componente necrotica è relativamente limitata (9). L’apoptosi correla con l’aumento del transforming growth factor beta (TGF-beta), un potente induttore di tale processo che agisce al contempo come citochina contro-regolatoria che limita la risposta infiammatoria (10).
Dopo 3-6 giorni dal contagio, compaiono per 3-5 giorni febbre e sintomi influenzali (brivido, cefalea, dolori ossei, mialgia, nausea, vomito). Segue un periodo di remissione di 1-2 giorni ed insorge poi la seconda fase con ittero, epatomegalia e coagulopatia che può evolvere verso una sindrome emorragica, l’insufficienza renale e lo shock circolatorio (7,8). Le AST sono più elevate delle ALT, v’è trombocitopenia, il PT e il PTT sono prolungati, aumentano il D-dimero ed i prodotti di degradazione del fibrinogeno per il subentrare di coagulazione intravascolare disseminata; l’esito clinico avverso correla con l’aumento delle aminotransferasi. Non v’è terapia specifica. Di recente è stato proposto il sofosbuvir sulla base di dati preliminari in vitro e nei topi, e dell’uso con favorevole esito clinico in due pazienti (11,12).
Il procedimento diagnostico più usato è la determinazione di anticorpi IgM contro il virus in ELISA; la procedura richiede poche ore e consente una diagnosi presuntiva di febbre gialla (1,8).
Tuttavia la sua specificità è gravata da cross-reattività con altri flavivirus, incluso il virus Dengue (13). La determinazione quantitativa del genoma virale in real time PCR (RT-PCR) permette una diagnosi più accurata ma è di limitata disponibilità (14). Il test LAMP RT-PCR, che non richiede strumentazione sofisticata, è stato usato per la diagnosi sul campo (15).
Vaccinazione
Il vaccino, sviluppato nel 1936 in Brasile, è costituito dal ceppo 17D del virus della febbre gialla, vivo ed attenuato (16). Sono usati due diversi sottotipi, 17DD in Brasile e 17D-204 dagli altri produttori (17).
Tutti i vaccini derivano da estratti di embrioni di pollo infetti (18). Il vaccino induce con una sola dose una rapida e robusta risposta dell’immunità innata; la protezione si stabilisce in 10 giorni nel 90-98% dei casi e nelle popolazioni delle aree endemiche dura per tutta la vita senza booster (19).
Nel 2016, l'OMS ha modificato il periodo di validità della vaccinazione contro la febbre gialla da 10 anni a tutta la vita anche per i viaggiatori internazionali. Tuttavia, l'ISS raccomanda di attenersi alle indicazioini dei CDC che prevedono un eventuale richiamo per le categorie a rischio e per chi si reca in zone ad alto rischio di trasmissione (20).
Il vaccino provoca nel 5% dei soggetti reazioni minori come febbre, cefalea, mialgia e lombalgie ed occasionalmente reazioni anafilattiche. Tuttavia il virus vaccinale 17D può raramente provocare infezione viscerotropica con compromissione multiorgano, fatale nel 60% dei casi, o neurovirulenza con meningite, encefalite o sindromi infiammatorie demielinizzanti (21,22); il rischio di compromissione multiorgano è stimato allo 0.4% per 100.000 e quello di complicazioni neurotropiche allo 0.2-0.8% (23,24), ma aumenta nei soggetti sopra i 60 anni (1.0-2.3% per 100.000) (25) ed in quelli con malattie autoimmuni, soggetti immunodepressi spontaneamente o farmacologicamente, malattie tiroidee, timoma, coinfezione da HIV (3).
Il vaccino è indicato nei soggetti che vanno o transitano in un’area endemica e in quelli che si recano in un paese che richiede un certificato internazionale di vaccinazione per l’ingresso (Figura 1) (26). Gli infanti, gli anziani >60 anni e gli immunodepressi a rischio delle complicazioni del vaccino non dovrebbero viaggiare nelle aree endemiche: se il viaggio è inevitabile devono usare abbigliamento protettivo e repellenti contro gli insetti sia per la pelle che per l’abbigliamento (3).
- Monath TP, Vasconcelos P. Yellow fever. J Clin Virol. 2015; 64:160-173.
- Monath TP. Treatment of yellow fever. Antiviral Res. 2008; 78:116-24.
- Reno E, Quan NG, Franco-Paredes C, et al Prevention of yellow fever in travellers: an update. Lancet Infect Dis. 2020; 20:e129-37.
- Vasconcelos P, Costa ZG, Travassos da Rosa ES, et al. An epidemic of jungle yellow fever in Brazil, 2000. Implications of climatic alterations in disease spread. J Med Virol. 2001; 65:598-604.
- Mondet B, Travassos da Rosa APA, Vasconcelos P. Les Risques D’Épidémisation Urbaine de la Fièvre Jaune au Brésil par les Vecteurs de la Dengue. Bull Soc Pathol Exot. 1996; 89:107-14.
- Garske T, Van Kerkhove MD, Yactayo S, et al. Yellow fever in Africa: estimating the burden of disease and impact of mass vaccination from outbreak and serological data. PLoS Med. 2014; 11:e1001638.
- Monath TP, Barrett AD. Pathogenesis and pathophysiology of yellow fever. Adv Virus Res. 2003; 60:343-395.
- van Leeuwen LPM, de Jong W, Doornekamp L, et al. Exotic viral hepatitis: review an epidemiology, pathogenesis, and treatment. J Hepatol. 2022; 77:1431-43.
- Quaresma JA, Duarte MI, Vasconcelos P. Midzonal lesions in yellow fever: a specific pattern of liver injury caused by direct virus action and in situ inflammatory response. Med Hypotheses. 2006; 67:618-621.
- ter Meulen J, Sakho M, Koulemou K, et al. Activation of the cytokine network and unfavorable outcome in patients with yellow fever. J Infect Dis. 2004; 190:1821-7.
- de Freitas CS, Higa LM, Sacramento CQ, et al. Yellow fever virus is susceptible to sofosbuvir both in vitro and in vivo. PLoS Negl Trop Dis. 2019; 13e0007072.
- Mendes ÉA, Pilger DRB, Santos Nastri ACS, et al. Sofosbuvir inhibits yellow fever virus in vitro and in patients with acute liver failure. Ann Hepatol. 2019; 18: 816-824.
- Trivino NH, Montana D, Castellanos JE. Dengue-yellow fever sera cross- reactivity. Challenges for diagnosis. Rev Saude Pública. 2008; 10:299-307.
- Wiysonge CS, Nomo E, Mawo J, et al. Yellow fever control in Cameroon: where are we now and where are we going? BMC Med. 2008; 6:3-7.
- Kwallah A, Inoue S, Mulgai AW et al. A real-time reverse transcription loop-mediated isothermal amplification assay for the rapid detection of yellow fever virus. J Virol Methods. 2013; 193:23-27.
- Collins ND, Barrett ADT. Live attenuated yellow fever 17D vaccine: a legacy vaccine still controlling outbreaks in modern day. Curr Infect Dis Rep 2017; 19:4.
- Monath TP, Gershman M, Staples EJ, Barrett ADT. Yellow fever vaccine. In: Plotkin SA, Orenstein WA, Offit PA, editors. Vaccines. 6th ed. Saunders Elsevier; 2012. p. 870-96 [chapter 36].
- World Health Organization. WHO Working Group on technical specifications for manufacture and evaluation of yellow fever vaccines, Geneva, Switzerland, 13-14 May 2009. Vaccine. 2010; 28:8236-45.
- Wieten RW, Jonker EFF, van Leeuwen EMM, et al. A single 17D yellow fever vaccination provides lifelong immunity; characterization of yellow-fever-specific neutralizing antibody and T-cell responses after vaccination. PLoS One. 2016; 11:e0149871.
- Ministero della Salute. Febbre gialla. Nuove norme sulla vaccinazione contro la febbre gialla. Circolare 10 ottobre 2016.
- Lindsey NP, Schroeder BA, Miller ER, et al. Adverse event reports following yellow fever vaccination. Vaccine. 2008; 26:6077-82.
- Monath TP. Review of the risks and benefits of yellow fever vaccination including some new analyses. Expert Rev Vaccines. 2012; 11:427-48.
- Gershman MD, Staples JE, Bentsi-Enchill AD, et al. Viscerotropic disease: case definition and guidelines for collection, analysis, and presentation of immunization safety data. Vaccine. 2012; 30:5038-58.
- Chan RC, Penney DJ, Little D, et al. Hepatitis and death following vaccination with 17D-204 yellow fever vaccine. Lancet. 2001; 358:121-2.
- Khromava AY, Eidex RB, Weld LH, et al. Yellow fever vaccine: an updated assessment of advanced age as a risk factor for serious adverse events. Vaccine. 2005; 23:3256-63.
- World Health Organization. Countries with risk of yellow fever transmission and countries requiring yellow fever vaccination (May 2021): WHO; 2021 [updated 26- 05-2021. Disponibile su: https://www.who.int/publications/m/item/countries-with-risk-of-yellow-fever-transmission-and-countries-requiring-yellow-fever-vaccination-(may-2021).






