L’importanza degli anticorpi (Abs) nella protezione contro le malattie infettive è stata documentata per la prima volta nei primi anni del secolo scorso. Gli anticorpi che neutralizzano HIV-1 (NtAbs) si legano all’envelope del virus ed in particolare alle glicoproteine gp120 e gp41.
E’ stato dimostrato che gli NtAbs possono neutralizzare moltissimi ceppi virali e, quindi, rappresentano strumenti molto attraenti per la generazione di vaccini e terapie immunologiche, sebbene nella storia naturale dell’infezione da HIV gli NtAbs siano difficili da elicitare e raggiungano un livello massimo del 50% nei soggetti HIV+ solo dopo circa due anni dall’infezione (1). Inoltre la straordinaria plasticità dell’envelope di HIV permette una diversità antigenica davvero eccezionale, permettendo quindi al virus di sfuggire al controllo degli Abs.
Risposte antivirali mediate dagli anticorpi
Gli Abs sono prodotti e secreti dai linfociti B per eliminare antigeni non-self in modo diretto o indiretto. Gli Abs possono agire come agenti antivirali attraverso una combinazione di differenti meccanismi tra cui:
- neutralizzazione diretta che previene l’infezione e la diffusione del virus;
- funzioni effettrici mediate dalla porzione Fc dello stesso, quali l’ADCC (Antibody Dependent Cell Citotoxicity);
- aumento delle risposte immunologiche antivirali dell’ospite attraverso l’attivazione di differenti tipi di cellule e l’incremento della presentazione dell’antigene (2). La neutralizzazione crea una specifica pressione immunologica sul virus HIV, mentre il ruolo di altre funzioni mediate dagli anticorpi nel generare una specifica pressione immune non è chiaro, in parte perché, ad esempio, gli Abs oltre ad agire come ADCC spesso hanno attività neutralizzante. Inoltre, numerosi studi hanno dimostrato che l’efficienza della eutralizzazione è dovuta sia alle caratteristiche del virus contro il quale sono diretti gli Abs, ma anche alla diversità anticorpale. La neutralizzazione autologa non sempre ha portato all’eliminazione dei virioni nei soggetti infetti.
Attività neutralizzante delle differenti classi anticorpali
Il sistema immune dei mammiferi produce diversi tipi di classi anticorpali, al fine di proteggere l’ospite da agenti esterni. Le differenti classi di Abs hanno un ruolo ben definito e spesso gli Abs che giocano un ruolo protettivo contro agenti microbici sono di tipo IgG, IgA monomeriche e dimeriche (queste ultime si trovano nelle mucose) e IgM, che generalmente fanno parte della risposta anticorpale primaria, e quindi sono le prime ad essere prodotte. Si è dimostrato che le IgM e le IgA possono neutralizzare molto meglio delle IgG, che invece sono quelle più comunemente usate nei vari schemi terapeutici (3, 4). Questa miglior attività delle IgM e IgA dimeriche rispetto alle IgG può attribuirsi ad una migliore affinità per il proprio antigene ed, inoltre, entrambe hanno più siti di riconoscimento antigenico rispetto alle IgG (le IgM sono pentameri e le IgA mucosali sono dimeri).
Il problema dell’immunotolleranza
In alcuni casi si è visto che Abs protettivi possono riconoscere proteine cellulari coinvolte nell’entry di HIV, come i CD4 e il CCR5 ed in altri casi potenti NtAbs diretti contro la gp41 (quali 2F5 e 4E10) riconoscono il repertorio self dell’ospite. Il controllo della tolleranza delle cellule B è in genere necessario per prevenire la generazione di Abs anti self o di malattie autoimmuni. Tuttavia, la tolleranza può presentare spazi vuoti nell’ambito del repertorio anticorpale e questi spazi possono essere utilizzati da patogeni, i cui antigeni possono avere una somiglianza molecolare con alcune proteine dell’ospite.
Da studi biochimici e strutturali si è dimostrato che HIV come patogeno si traveste ed alcune proteine virali vengono camuffate come se fossero proteine dell’ospite. Di conseguenza, le strategie vaccinali tradizionali possono fallire nell’elicitare alcuni specifici tipi di anticorpi (5, 6).
È interessante notare che in alcune malattie autoimmuni, come la sclerosi multipla o il lupus eritematoso sistemico, ci sia una correlazione inversa tra infezione da HIV e insorgenza di patologia autoimmune ed è stato dimostrato che anticorpi anti HISTONE-2a sono protettivi contro l’infezione da HIV nel modello murino (7).
Anticorpi neutralizzanti utilizzati nei trial clinici
Gli NtAbs sono stati isolati negli ultimi anni. Un primo pannello di NtAbs identificati comprendeva 2F5, 2G12 e 4E10 che sono stati poi utilizzati come immunoterapia passiva (8).
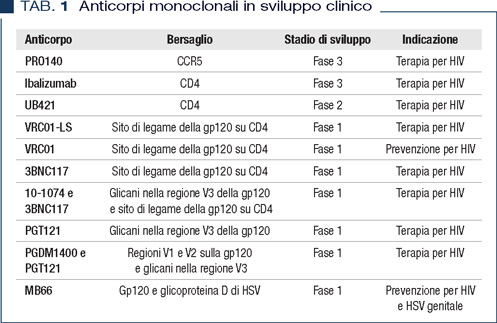 Nell’ultimo decennio, utilizzando gli NtAbs, si è giunti all’identificazione di un ristretto numero di epitopi virali che sono vulnerabili alla neutralizzazione (9). La nuova generazione di NtAbs ne comprende 10 che sono attualmente impiegati nei trial clinici (Tabella 1). In particolare negli ultimi due anni gli anticorpi VRC01, 3BNC117 (entrambi riconoscono il sito di legame al recettore CD4) e 10-1074 (si lega ai glicani della regione V3 sulla gp120) hanno mostrato un effettivo beneficio terapeutico in pazienti HIV+ (10-12).
Nell’ultimo decennio, utilizzando gli NtAbs, si è giunti all’identificazione di un ristretto numero di epitopi virali che sono vulnerabili alla neutralizzazione (9). La nuova generazione di NtAbs ne comprende 10 che sono attualmente impiegati nei trial clinici (Tabella 1). In particolare negli ultimi due anni gli anticorpi VRC01, 3BNC117 (entrambi riconoscono il sito di legame al recettore CD4) e 10-1074 (si lega ai glicani della regione V3 sulla gp120) hanno mostrato un effettivo beneficio terapeutico in pazienti HIV+ (10-12).
Gli ultimi traguardi ottenuti con gli anticorpi
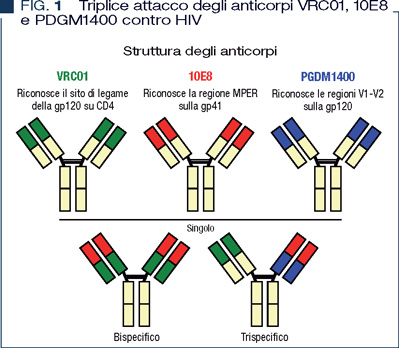 L’importanza degli anticorpi nella medicina è cresciuta moltissimo dal 1975, anno in cui Kohler e Milstein hanno prodotto per la prima volta anticorpi monoclonali ricombinanti (13). Nonostante la potenza di alcuni NtAbs, nessun singolo NtAb ha protetto contro le diverse varianti virali presenti nei soggetti HIV+. Perciò molto recentemente Xu e colleghi hanno generato un anticorpo ibrido trispecifico che riconosce quindi tre differenti regioni sull’envelope (Figura 1). Questo NtAb si è dimostrato molto promettente nel modello dei primati, in quanto ha protetto tutti gli animali infettati con HIV, invece solo il 25-30% degli animali trattati con i singoli anticorpi o con anticorpi bispecifici sono risultati protetti (14). Visto l’ampio spettro di epitopi e di virus riconosciuti da questo nuovo tipo di NtAbs, questi potrebbero rappresentare una nuova frontiera sia per la prevenzione (bloccando il virus a livello mucosale), sia nella terapia ed, infine, anche nella cura. In effetti si è visto che le specie virali presenti in pazienti trattati con 3BNC117 dopo interruzione della terapia antiretrovirale non sono quelle tipiche presenti nei reservoir ma rappresentano dei virus ricombinanti (15).
L’importanza degli anticorpi nella medicina è cresciuta moltissimo dal 1975, anno in cui Kohler e Milstein hanno prodotto per la prima volta anticorpi monoclonali ricombinanti (13). Nonostante la potenza di alcuni NtAbs, nessun singolo NtAb ha protetto contro le diverse varianti virali presenti nei soggetti HIV+. Perciò molto recentemente Xu e colleghi hanno generato un anticorpo ibrido trispecifico che riconosce quindi tre differenti regioni sull’envelope (Figura 1). Questo NtAb si è dimostrato molto promettente nel modello dei primati, in quanto ha protetto tutti gli animali infettati con HIV, invece solo il 25-30% degli animali trattati con i singoli anticorpi o con anticorpi bispecifici sono risultati protetti (14). Visto l’ampio spettro di epitopi e di virus riconosciuti da questo nuovo tipo di NtAbs, questi potrebbero rappresentare una nuova frontiera sia per la prevenzione (bloccando il virus a livello mucosale), sia nella terapia ed, infine, anche nella cura. In effetti si è visto che le specie virali presenti in pazienti trattati con 3BNC117 dopo interruzione della terapia antiretrovirale non sono quelle tipiche presenti nei reservoir ma rappresentano dei virus ricombinanti (15).
Bibliografia
- Borrow P, Moody MA. Immunologic characteristics of HIV-infected individuals who make broadly neutralizing antibodies. Immunological rev 2017; 275:62.
- Lu LL, Suscovich TJ, Fortune SM, Alter G. Beyond binding: antibody effector functions in infectious diseases. Nat Rev Immunol. 2018; 18:46.
- Gong S, Tomusange K, Kulkarni V, et al. Anti-HIV IgM protects against mucosal SHIV transmission. AIDS 2018; 32:F5.
- Tudor D, Yu H, Maupetit J, et al. Isotype modulates epitope specificity, affinity, and antiviral activities of anti-HIV-1 human broadly neutralizing 2F5 antibody. Proc Natl Acad Sci USA. 2012; 109:12680.
- Finney J, Kelose G. Poly- and autoreactivity of HIV-1 bNAbs: implications for vaccine design. Retrovirology 2018; 15:53.
- Venuti A, Pastori C, Lopalco L. The role of Natural Antibodies to CC Chemokine Receptor 5 in HIV infection. Front Immunol. 2017; 8:1358.
- Schroeder KMS, Agazio A, Strauch PJ, Jones ST, Thompson SB, et al. Breaching peripheral tolerance promotes the production of HIV-1-neutralizing antibodies. J Exp Med. 2017; 214:2283.
- Armbruster C, Stiegler GM, Vcelar BA, et al. Passive immunization with the anti-HIV-1 human monoclonal antibody (hMAb) 4E10 and the hMAb combination 4E10/2F5/2G12. J Antimicrob Chemother. 2004; 54:915.
- Alter G, Barouch D. Immune Correlate-Guided HIV Vaccine Design. Cell Host Microbe 2018; 24:25.
- Bar KJ, Sneller MC, Harrison LJ, et al. Effect of HIV antibody VRC01 on viral rebound after treatment inter-ruption. N Engl J Med 2016; 375:2037.
- Caskey M, Schoofs T, Gruell H, et al. Antibody 10-1074 suppresses viremia in HIV-1-infected individuals. Nat Med 2017; 23:185.
- Schoofs T, Klein F, Braunschweig M, et al. HIV-1 therapy with monoclonal antibody 3BNC117 elicits host immune responses against HIV-1. Science 2016; 352:997.
- Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256:495.
- Xu L, Pegu A, Rao E, et al. Trispecific broadly neutralizing HIV antibodies mediate potent SHIV protection in macaques. Science 2017; 358:85.
- Cohen YZ, Lorenzi JCC, Krassnig L, et al. Relationship between latent and rebound viruses in a clinical trial of anti-HIV-1 antibody 3BNC117. J Exp Med 2018; 215(9):2311-2324.






