Gli anticorpi (Abs), proteine prodotte naturalmente dall’organismo in risposta a stimoli infettivi, sono fondamentali per l'immunità contro le malattie infettive e sono stati utilizzati nella prevenzione e nel trattamento delle infezioni batteriche e virali per più di un secolo. La storia della medicina annovera 5 premi Nobel per le scoperte relative al trattamento di malattie infettive con anticorpi (Emil Adolf von Behring nel 1901), descrivendo l'immunità umorale (Paul Ehrlich e Il'ja Il'ič Mečnikov nel 1908), definendo la struttura chimica degli Abs (Rodney Robert Porter e Gerald M. Edelman nel 1972), la produzione di anticorpi monoclonali (MoAbs) (Niels Kaj Jerne, Georges Köhler e Cesar Milstein nel 1984), e spiegando il meccanismo della diversità anticorpale (Susumu Tonegawa nel 1987).
Recentemente, i MoAbs terapeutici sono diventati strumenti essenziali per affrontare varie malattie, comprese le infezioni virali come il virus Ebola, il virus della rabbia, il virus respiratorio sinciziale, il Clostridium difficile, sulla base delle loro capacità di prevenire la progressione della malattia subito dopo la somministrazione e di accelerare il recupero, indipendentemente dal fatto che il paziente abbia sviluppato completamente l'immunità.
Nell'ultimo anno, straordinarie risorse biomediche e finanziarie sono state dedicate al rapido sviluppo di misure diagnostiche, profilattiche e terapeutiche per l’infezione da SARS-CoV-2.
Grazie alla loro alta specificità e versatilità, i MoAbs sono in prima linea su tutti e tre questi fronti nella lotta contro COVID-19.
I MoAbs anti-SARS-CoV-2
I MoAbs anti-SARS-CoV-2 sono prodotti in laboratorio e possono essere derivati dalle cellule B di persone convalescenti o topi umanizzati esposti agli antigeni del virus SARS-CoV-2 (1).
Il loro bersaglio principale è il dominio di legame al recettore (RBD) della glicoproteina spike (S) del virus SARS-CoV-2 e recentemente sono stati descritti diversi MoAbs neutralizzanti che mirano a diversi epitopi all'interno della proteina S del virus (2).
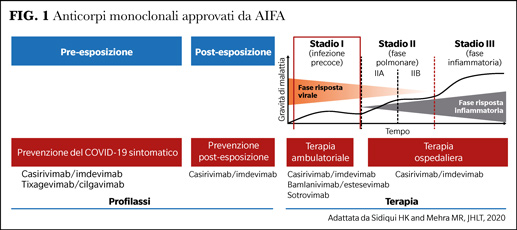 I MoAbs, progettati per imitare e precedere la risposta immunitaria naturale dell’organismo, sono disponibili come trattamento e come prevenzione del COVID-19 per i pazienti ad alto rischio di progressione verso la malattia grave. Possono essere utilizzati in profilassi primaria per prevenire l'insorgere della malattia e in profilassi secondaria per evitare il peggioramento della patologia (Figura 1).
I MoAbs, progettati per imitare e precedere la risposta immunitaria naturale dell’organismo, sono disponibili come trattamento e come prevenzione del COVID-19 per i pazienti ad alto rischio di progressione verso la malattia grave. Possono essere utilizzati in profilassi primaria per prevenire l'insorgere della malattia e in profilassi secondaria per evitare il peggioramento della patologia (Figura 1).
Il loro utilizzo in profilassi primaria (pre-esposizione) è stato possibile grazie alle tecnologie più recenti che modificano la regione Fc dell'anticorpo per estendere l'emivita dei MoAbs così da fornire livelli potenzialmente protettivi per mesi, a seconda delle concentrazioni richieste.
Ad oggi questi Abs sono indicati per gli individui vulnerabili e immunocompromessi che possono non sviluppare una risposta immunitaria adeguata alla vaccinazione anti-COVID-19 o persone che non hanno potuto effettuare il ciclo completo vaccinale per allergia a componenti vaccinali.
Sviluppo, utilizzo e risultati degli studi
Il primo cocktail di MoAbs licenziato è stato casirivimab/imdevimab per il trattamento in profilassi primaria in data 27 novembre 2021, con indicazione per pazienti adulti e in pazienti adolescenti, di età ≥ 12 anni (600 mg di casirivimab e 600 mg di imdevimab) somministrati in un'unica infusione endovenosa oppure mediante iniezione sottocutanea. Vi è indicazione ad una somministrazione di dosi successive con dose dimezzata ogni 4 settimane fino a quando la profilassi non risulterà più necessaria (3). Il cocktail casirivimab/imdevimab però ad oggi è stato scarsamente utilizzato per il cambiamento della circolazione epidemiologica delle varianti di interesse (VoC).
Il secondo cocktail di MoAbs licenziato è stato tixagevimab/cilgavimab (AZD7442), cocktail di due MoAbs che ha come target il dominio RDB della proteina S. Il prodotto è stato ottimizzato per un'emivita estesa e una maggiore durata d'azione, attraverso la riduzione del legame dei suoi ingredienti al recettore Fc e al complemento C1q e sembra avere in vitro un’attività sulle VoC come Omicron, Delta e Mu (4). I dati che supportano l’utilizzo di AZD7442 provengono dallo studio multicentrico randomizzato (2:1) in doppio cieco di fase 3 PROVENT per la valutazione dell’efficacia nella profilassi pre-esposizione, che arruolava persone >18 anni, non vaccinate e che non avevano infezione da SARS-CoV-2 al basale. Sono stati reclutati un totale di 5.197 partecipanti con un’età media di 53 anni, il 75% dei quali aveva comorbidità che aumentavano il rischio di malattia grave. Il gruppo di trattamento, composto da 3.460 partecipanti ai quali è stata somministrata una singola dose intramuscolare di 300 mg di AZD7442, è stato confrontato con il gruppo placebo di 1.737 partecipanti. Lo studio ha dimostrato che AZD7442 ha ridotto il rischio di sviluppare COVID-19 sintomatico del 77% (95% CI, 46-90) nel gruppo di trattamento rispetto al gruppo placebo. Una dose di AZD7442 si è dimostrata in grado di fornire una protezione duratura contro l’infezione da SARS-CoV-2 almeno di 6 mesi (5).
A giugno 2021 sono stati pubblicati i dati dello studio BLAZE-2, uno studio clinico randomizzato, in doppio cieco di fase 3 volto a valutare l’efficacia di bamlanivimab nella prevenzione del COVID-19 in infermieri, personale e persone residenti di strutture assistenziali. Da agosto a novembre 2020, sono state arruolate 1.297 persone in 74 strutture assistenziali con almeno 1 caso indice confermato di SARS-CoV-2, che avevano un tampone negativo al basale e la sierologia della SARS-CoV-2 negativa. Tutte le persone residenti nella struttura facevano parte di categorie ad elevato rischio di progressione, mentre ricadeva in questa categoria il 41% dello staff. Lo studio ha esaminato i dati di 966 partecipanti con età media di 53 anni (74% donne), del gruppo di trattamento che ha incluso 484 partecipanti a cui è stato somministrato bamlanivimab e del gruppo di controllo di 482 partecipanti che ha ricevuto il placebo. Bamlanivimab si è dimostrato efficace nel ridurre l’incidenza di infezione da SARS-CoV-2 rispetto al placebo (8,5% vs. 15,2%) (6).
Recentemente è stata sequenziata la nuova variante Omicron di SARS-CoV-2 con la presenza di circa 30 mutazioni nella proteina spike che contribuiscono ad una maggiore infettività e all’evasione dalla risposta immunitaria prodotta degli Abs acquisiti naturalmente, dalla risposta vaccinale e dai MoAbs terapeutici (7).
In un comunicato stampa del 16 dicembre, AstraZeneca ha riferito che la combinazione di MoAbs AZD7442 ha mantenuto in vitro attività neutralizzante contro la VoC Omicron (8).
A maggio 2022 è stata prevista la chiusura dello studio di fase 3 NCT05074433, randomizzato in doppio cieco volto a valutare l'efficacia e la sicurezza di casirivimab/imdevimab nella prevenzione di COVID-19 sia in adolescenti che adulti immunocompromessi. Lo studio ha come obiettivo primario la valutazione dell’incidenza cumulativa di infezioni da SARS-CoV-2.
Infine a gennaio scorso è iniziato l’arruolamento per lo studio di fase I COVIDMAB (NCT05135650) che ha come obiettivo principale la valutazione della farmacocinetica di sotrovimab nei destinatari di trapianto di cellule staminali ematopoietiche. È prevista la somministrazione di sotrovimab prima dell'inizio del condizionamento pre-trapianto. Negli obiettivi secondari lo studio si propone di valutare la frequenza in questa popolazione di infezione da SARS-CoV-2 e pertanto il suo utilizzo in questo gruppo di pazienti in profilassi primaria pre-esposizione.
Le limitazioni all’uso dei MoAbs sono dovute alla limitata disponibilità degli stessi, attualmente quasi esclusiva dei paesi ad alto reddito, al costo elevato, ai tempi richiesti per l'approvazione regolatoria per l’uso clinico routinario, alle difficoltà di approvvigionamento durante i picchi epidemici di COVID-19, e infine al cambiamento delle VoC circolanti che possono variare la suscettibilità alle terapie con MoAbs. In taluni casi, come per casirivimab/imdevimab, il farmaco ha ricevuto l’indicazione registrativa quando il suo uso nella pratica clinica non è più raccomandato in base alla suscettibilità in vitro delle VoC circolanti.
Il plasma iperimmune
Un’alternativa è rappresentata dal plasma di convalescente (CP) iperimmune, disponibile nei paesi a basso e medio reddito, senza limitazioni di brevetto e con costi relativamente contenuti.
Il CP fornisce una miscela diversificata di Abs con diverse specificità e funzioni, e dovrebbe essere meno vulnerabile all'emergere di una resistenza anticorpale a varianti virali.
Ad oggi il CP è stato utilizzato nei pazienti con COVID-19 con risultati spesso insoddisfacenti (9). Evidenze scientifiche a favore dell’uso del CP sono descritte nei pazienti trattati con trasfusione di plasma ad alto titolo entro i primi 3 giorni fino a 9 giorni dall'inizio dei sintomi nei pazienti non ospedalizzati (10, 11). Non esistono indicazioni sull’utilizzo del CP nella profilassi pre-esposizione, ma, considerate le caratteristiche, potrebbe essere una valida opzione soprattutto nei periodi di limitato approvvigionamento dei MoAbs. Attualmente il trial NCT04377672 sta valutando questa opzione nei bambini immunodepressi.
Nuovi MoAbs entreranno negli studi clinici nei prossimi mesi e saranno valutati per la loro capacità di limitare o modificare l'infezione da SARS-CoV-2. Stabilire l'efficacia terapeutica e profilattica del CP così come già dimostrato per i MoAbs rappresenterebbe un passo in avanti nel controllo della pandemia di COVID-19 specie nelle categorie più vulnerabili come i pazienti con malattia autoimmune, oncoematologica o neurologica.
- Taylor PC, Adams AC, Hufford MM, et al. Neutralizing monoclonal antibodies for treatment of COVID-19. Nature Reviews Immunology. Springer Science and Business Media LLC. 2021; 21:382-93.
- Du L, He Y, Zhou Y, et al. The spike protein of SARS-CoV — a target for vaccine and therapeutic development. Nature Reviews Microbiology. Springer Science and Business Media LLC. 2009; 7:226-36.
- https://www.aifa.gov.it/documents/20142/961234/Determina_155-2021_Ronapreve.pdf
- Loo Y-M, Mctamney PM, Arends RH, et al. The SARS-CoV-2 monoclonal antibody combination, AZD7442, is protective in nonhuman primates and has an extended half-life in humans (Internet). Vol. 14, Science Translational Medicine. American Association for the Advancement of Science; 2022: 14: eabl8124.
- AstraZeneca. Evusheld long-acting antibody combination retains neutralizing activity against Omicron variant in independent FDA study. December 16, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/evusheld-long-acting-antibody-combination-retains-neutralising-activity-against-omicron-variant-in-independent-fda-study.html
- Cohen MS, Nirula A, Mullingan MJ, et al. Effect of Bamlanivimab vs Placebo on Incidence of COVID-19 Among Residents and Staff of Skilled Nursing and Assisted Living Facilities. JAMA. 2021; 32:46.
- Qin S, Mengnan C, Siqi S, et al. Genome characterization and potential risk assessment of the novel SARS-CoV-2 variant omicron B.1.1.529. Zoonoses. 2021; 1:13.
- https://www.astrazeneca.com/media-centre/press-releases/2021/evusheld-long-acting-antibody-combination-retains-neutralising-activity-against-omicron-variant-in-independent-fda-study.html
- Focosi D, Farrugia A. The art of the possible in approaching efficacy trials for COVID-19 convalescent plasma. Int J Infect Dis. 2021; 102:244-246.
- Sullivan DJ, Gebo KA, Shoham S, et al. Early Outpatient Treatment for COVID-19 with Convalescent Plasma. N Engl J Med. 30 March 2022; 386(18): 1700-1711.
- Libster R, Gonzalo PM, Wappner D, et al. Early High-Titer Plasma Therapy to Prevent Severe COVID-19 in Older Adults New England Journal of Medicine. 2021; 384:610-8.






