Se da un punto di vista clinico le linee guida internazionali sono concordi sulle scelte terapeutiche riguardanti le due principali infezioni fungine invasive, cioè quelle sostenute da Candida e Aspergillus (entrambe associate a tassi di mortalità prossimi o superiori al 50%) (1,2), sul piano farmacologico clinico le maggiori criticità per una gestione ottimale della terapia antifungina nel paziente critico sono costituite dall’identificazione del regime posologico che garantisca al meglio e il più precocemente possibile il raggiungimento del target farmacodinamico di efficacia terapeutica e dalla scelta della molecola più performante in relazione a specifici siti di infezione. A questo proposito, il ruolo del farmacologo clinico è quello di comprendere i fattori di variabilità che influiscono sull’esposizione al farmaco e di contestualizzarli in relazione alla fisiopatologia del paziente.
Variabilità farmacocinetica e rischio di sottoesposizione plasmatica
Un’estensione dello studio DALI, che ha coinvolto 68 terapie intensive in Europa e che era finalizzato a valutare l’adeguatezza dell’esposizione a fluconazolo, anidulafungina e caspofungina nel paziente critico, ha evidenziato che il 33% dei pazienti in terapia con fluconazolo non raggiungeva il target farmacocinetico/farmacodinamico (PK/PD) ottimale e che l’esposizione media in termini di AUC24h per tutti e tre gli antifungini analizzati era significativamente inferiore a quella osservata nel volontario sano (3). Fluconazolo, a differenza degli altri azoli, è una molecola idrosolubile la cui clearance è fortemente dipendente dalla funzionalità renale.
La condizione fisiopatologica dell’augmented renal clearance (ARC), ovvero di un valore di filtrato glomerulare ≥130 mL/min/1.73m2, cosi come l’applicazione di terapie reali sostitutive come la CVVH (emofiltrazione veno-venosa continua), si associano ad un rischio importante di sottoesposizione al farmaco. Inoltre, la presenza di sepsi o shock settico con la disfunzione endoteliale e il capillary leakage che ne conseguono, possono portare ad un aumento del volume di distribuzione di fluconazolo, con una conseguente riduzione delle concentrazioni plasmatiche. Nel paziente critico l’utilizzo della dose da carico e di dosi di mantenimento elevate (da 400 a 800 mg/die) appare necessario per raggiungere il target PK/PD ottimale.
Per quanto riguarda l’utilizzo delle echinocandine nel paziente critico, si può identificare un differente comportamento di anidulafungina e micafungina rispetto a caspofungina. Per anidulafungina e micafungina i dati a nostra disposizione hanno evidenziato che l’AUC24h di questi due antifungini è significativamente inferiore rispetto a quella del volontario sano, mentre per caspofungina non vi sarebbero sostanziali differenze.
Dal momento che le echinocandine sono legate per oltre il 90% alle proteine plasmatiche, l’ipoalbuminemia, che è una condizione presente nel 40-50% dei pazienti critici, contribuisce a ridurre significativamente la concentrazione plasmatica di questi farmaci, come è stato evidenziato da diversi studi di farmacocinetica di popolazione. Inoltre, essendo micafungina circa 10 volte più idrosolubile delle altre echinocandine, è verosimile che le alterazioni nel volume di distribuzione comuni nel paziente critico possano influenzarne maggiormente il profilo farmacocinetico.
Da un punto di vista farmacodinamico, è interessante notare che alle dosi raccomandate di caspofungina (70 mg carico e 50 mg/die), micafungina (100 mg/die) e anidulafungina (200 mg carico e 100 mg/die) le frazioni cumulative di risposta nel paziente critico nei confronti di C. albicans sono risultate rispettivamente di 95.8%, 13.5% e 50.5%; nei confronti di C. glabrata di 99.4%, 90.6% e 44.6%; nei confronti di C. parapsilosis <70% per tutte e tre le molecole, mentre solo caspofungina al dosaggio di 100 mg/die permetteva di raggiungere valori >80% (4). Da questi dati si può desumere che la dose raccomandata di caspofungina sia appropriata nel paziente critico, mentre un dosaggio maggiore è necessario per anidulafungina e micafungina nella terapia della candidemia.
Infezioni gravi da Candida
Per quanto riguarda il trattamento delle forme più gravi di candidiasi profonda, la candidiasi intraddominale e l’endoftalmite, bisogna ricordare che le echinocandine hanno una scarsa penetrazione in questi siti. In particolare su 31 pazienti critici post-chirurgici è stato calcolato un rapporto di penetrazione liquido peritoneale/plasma del 27.1%, 19.1% e 13.1% rispettivamente per anidulafungina, micafungina e caspofungina (5). Nella terapia dell’endoftalmite da Candida le echinocandine non devono rappresentare mai la prima scelta, in considerazione della loro scarsissima penetrazione in questo sito (6). Gli azoli voriconazolo o fluconazolo, avendo una penetrazione >90%, rappresentano invece i farmaci di riferimento. Per quanto riguarda l'amfotericina B liposomiale, la penetrazione nel liquido ascitico è limitata al 46% per la concentrazione minima e a circa il 4% per quella massima, cosa che rende subottimale il raggiungimento del target farmacodinamico di efficacia. A livello intraoculare, la penetrazione nel modello murino ad occhio infiammato è del 2.9-4.5%.
Aspergillosi invasiva
Voriconazolo rappresenta la prima linea terapeutica per il trattamento dell’aspergillosi invasiva. Tra i triazoli, voriconazolo è quello dotato della maggiore variabilità farmacocinetica inter-individuale. Questo farmaco è totalmente metabolizzato dal fegato, e il principale enzima deputato alla sua biotrasformazione, specificamente il citocromo CYP2C19, è ampiamente polimorfico. Nella popolazione caucasica, approssimativamente il 20% degli individui sono metabolizzatori rapidi o ultrarapidi mentre i metabolizzatori lenti sono il 2-5%. Questo determina che l’uso di voriconazolo nella popolazione caucasica si associa frequentemente a sottoesposizione plasmatica con rischio di fallimento terapeutico (7). Nel paziente critico inoltre è molto frequente che vi sia uno stato di infiammazione sistemica, legata allo stato di sepsi/shock settico, a stati infettivi, a reazioni immunomediate come la sindrome da rilascio di citochine o stati neoplastici. In tali condizioni, le citochine infiammatorie possono esercitare un effetto inibitorio a livello dei citocromi epatici, portando ad una riduzione dell’eliminazione dei farmaci da essi metabolizzati (8), con conseguente accumulo e rischio di tossicità.
Il ruolo del TDM
Sulla base di queste considerazioni, personalizzare la posologia nel singolo paziente è essenziale vieppiù nel contesto del paziente critico. Il monitoraggio terapeutico del farmaco (TDM) rappresenta lo strumento principale che il farmacologo clinico ha a disposizione per ottimizzare il dosaggio di farmaci dotati di una finestra terapeutica ristretta come è appunto il caso di voriconazolo. Al giorno d’oggi il ricorso all’aggiustamento posologico basato sul TDM è imprescindibile in un paziente in terapia con voriconazolo. Il range terapeutico è stato validato clinicamente e prevede che il TDM sia effettuato in terza giornata nei pazienti che hanno assunto la dose da carico e che la concentrazione pre-somministrazione sia compresa tra 1.0 e 5.5 mg/L (nella popolazione caucasica) o tra 1.0 e 4.0 mg/L (negli asiatici) (7).
Aspergillosi cerebrale
Per quanto riguarda il trattamento di una delle complicanze più severe dell’aspergillosi invasiva, e cioè l’aspergillosi cerebrale, è opportuno sottolineare come sia voriconazolo che isavuconazolo, in quanto molecole di natura altamente liposolubile, hanno una penetrazione ottimale a livello cerebrale e pertanto sono raccomandate come prima linea terapeutica. Tuttavia in questo contesto è opportuno mantenere concentrazioni maggiori di quelle sopraindicate con valori non inferiori a 6 mg/L per voriconazolo. Amfotericina B è raccomandata in caso di intolleranza a voriconazolo, o di interazioni gravi che ne precludono l’utilizzo o in caso di specie di Aspergillo resistenti agli azoli. La penetrabilità cerebrale di amfotericina B è in genere <30% (nel modello murino, L-AMB alla dose di 5 mg/kg/die si associa all’AUC e Cmax più elevati rispetto alle altre formulazioni lipidiche). Inoltre, non sembra che alterazioni nella funzionalità renale o altre condizioni fisiopatologiche possano influenzare l’esposizione al farmaco (9).
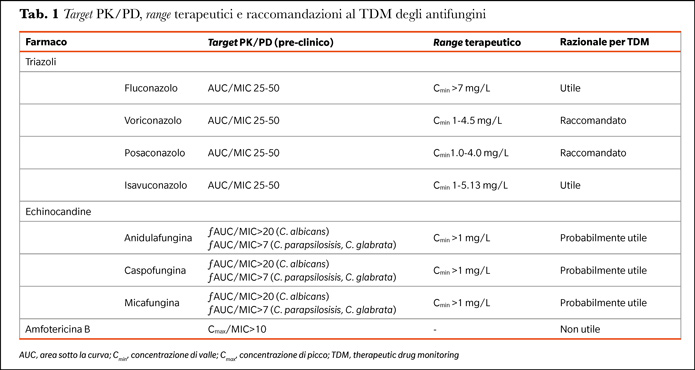
Sebbene non per tutti gli antifungini vi siano delle raccomandazioni per effettuare il TDM, è bene sottolineare che in genere per tutti gli azoli e probabilmente anche per le echinocadine in particolare nel contesto del paziente critico e di quello obeso, il TDM si dimostra uno strumento importante per l’ottimizzazione della dose (Tabella 1) (10) posto che il clinico possa disporre di una corretta interpretazione farmacologico-clinica del dato del TDM.
- Vincent JL, Rello J, Marshall J et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA 2009;302:2323-9.
- Jenks JD, Nam HH, Hoenigl M. Invasive aspergillosis in critically ill patients: Review of definitions and diagnostic approaches. Mycoses 2021;64, 1002-14.
- Sinnollareddy MG, Roberts JA, Lipman J et al. Pharmacokinetic variability and exposures of fluconazole, anidulafungin, and caspofungin in intensive care unit patients: Data from multinational Defining Antibiotic Levels in Intensive care unit (DALI) patients Study. Crit Care 2015;19:33.
- Yang Q, Wang T, Xie J et al. Pharmacokinetic/pharmacodynamic adequacy of echinocandins against Candida spp. in intensive care unit patients and general patient populations. Int J Antimicrob Agents 2016;47:397-402.
- Gioia F, Gomez-Lopez A, Alvarez ME et al. Pharmacokinetics of echinocandins in suspected candida peritonitis: a potential risk for resistance. Int J Infect Dis 2020;101:24-28.
- Gauthier GM, Nork TM, Prince R et al. Subtherapeutic ocular penetration of caspofungin and associated treatment failure in Candida albicans endophthalmitis. Clin Infect Dis 2005;41:e27-8.
- Takesue, Y.; Hanai, Y.; Oda, K., et al. Clinical Practice Guideline for the Therapeutic Drug Monitoring of Voriconazole in Non-Asian and Asian Adult Patients: Consensus Review by the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. Clin Ther 2022;44:1604-23.
- Cojutti PG, Londero A, Della Siega P et al. Comparative Population Pharmacokinetics of Darunavir in SARS-CoV-2 Patients vs. HIV Patients: The Role of Interleukin-6. Clin Pharmacokinet 2020;59:1251-60.
- Van Daele R, Wauters J, Elkayal O et al. Liposomal amphotericin B exposure in critically ill patients: a prospective pharmacokinetic study. Med Mycol 2022;60:myac074
- John J, Loo A, Mazur S et al. Therapeutic drug monitoring of systemic antifungal agents: a pragmatic approach for adult and pediatric patients. Expert Opin Drug Metab Toxicol 2019;15:ssssssss881-95.






