Imipenem-cilastatina-relebactam (IMI/REL) è la combinazione di imipenem/cilastatina (IMI) con un nuovo inibitore delle beta-lattamasi di classe A/C (relebactam, REL), che ha ricevuto l’approvazione da parte della FDA nel 2019 e da EMA nel 2020 per il trattamento delle infezioni complicate del tratto urinario (cUTI) e intra-addominali (cIAI), con successiva estensione alle polmoniti nosocomiali (HAP) e a quelle associate al ventilatore (VAP) sostenute da patogeni Gram-negativi con limitate opzioni di trattamento (1). Il dosaggio approvato è 500 mg imipenem, 500 mg cilastatina e 250 mg REL (infusione della durata di 30 minuti) ogni 6 ore.
Attività in vitro
L’aggiunta di REL è in grado di ripristinare l’attività di IMI nei confronti di Enterobacterales e P. aeruginosa IMI-resistenti. Infatti, REL è un nuovo diazabicicloottano inibitore delle beta-lattamasi di classe A (KPC, TEM, SHV e CTX-M) e di classe C (ampC e Pseudomonas-derived cephlosporinase, PDC), mentre non presenta attività nei confronti delle beta-lattamasi di classe B (NDM, VIM, IMP) e D (OXA).
La struttura di REL è simile a quella di avibactam (AVI), anch’esso caratterizzato dalla presenza di un core diazabicicloottano; tuttavia, rispetto ad AVI, REL possiede un anello di piperidina che lo rende più stabile nei confronti di KPC-2 e ne previene l’efflusso dalla cellula batterica. L’attività di REL non è influenzata dalla presenza delle pompe di efflusso prodotte da P. aeruginosa (MexAB-OprM, MexCD-OprJ, MexXY-OprM).
Uno studio in vitro effettuato su 101 isolati di Enterobacterales KPC-produttrici ha mostrato come tutti gli isolati fossero altamente suscettibili a IMI/REL (MIC≤2mg/L). Gli autori hanno anche dimostrato come REL sia un potente inibitore dell’enzima KPC-2 (2).
Recentemente, è stato dimostrato come ceppi con iper-espressione di KPC e alterazioni delle porine fossero resistenti in vitro a ceftazidime/avibactam (CAZ/AVI) e meropenem/vaborbactam (MER/VAB) ma non a IMI/REL, probabilmente a causa di una minore influenza su IMI/REL di mutazioni a livello della porina OmpK36 (3).
Lo studio SMART ha mostrato che l’aggiunta di REL ha ripristinato la suscettibilità a IMI nell’80.5% e nel 74.1% degli isolati di P. aeruginosa e K. pneumoniae IMI non-suscettibili, rispettivamente. Più recentemente, sempre la sorveglianza SMART (2015-2017) ha confermato questi dati incoraggianti, mostrando che il 92.2% degli isolati di P. aeruginosa isolati dal tratto respiratorio erano suscettibili a IMI/REL, incluso il 77.2% dei ceppi IMI non-suscettibili e il 79.6% degli isolati multi-drug resistant (MDR) (4). In una raccolta di 1.445 isolati clinici di P. aeruginosa, IMI/REL ha mostrato MIC50/90=0.5/1 mg/L, rispettivamente, 4 e 16 volte inferiori rispetto a quelle di IMI da solo.
Come atteso, tutti gli isolati resistenti a IMI/REL erano produttori di carbapenemasi del tipo VIM, IMP e GES-5.
Resistenza a IMI/REL
In Enterobacterales KPC-produttrici, la resistenza a IMI/REL è prevalentemente causata da mutazioni o da iper-espressione dell’enzima KPC e/o da mutazioni a carico della porina OmpK36 o distruzione della porina OmpK35.
Per quanto riguarda P. aeruginosa, i maggiori determinanti di resistenza a IMI/REL sono la presenza di carbapenemasi GES (in modo particolare GES-5) e la perdita della porina OprD.
PK/PD
Il legame alle proteine plasmatiche è pari a circa il 20%, 40% e 22% per imipenem, cilastatina e REL, rispettivamente. IMI/REL è prevalentemente escreto per via renale: il 63%, 77% e >90% della dose somministrata di imipenem, cilastatina e REL si riscontra nelle urine in forma intatta, rispettivamente. Pertanto, nei pazienti con una clearance della creatinina <90 mL/min, è necessario un aggiustamento del dosaggio.
REL a concentrazioni clinicamente rilevanti non inibisce i CYP, rendendo improbabili potenziali interazioni farmacologiche clinicamente significative con farmaci metabolizzati attraverso tale via; sebbene IMI/REL sia un substrato dei trasportatori OAT3, OAT4, MATE1 e MATE2K, non sono state dimostrate interazioni farmacologiche mediate da questi.
L’emivita di REL è simile a quella di IMI, supportandone quindi la co-somministrazione. La penetrazione nel liquido del rivestimento epiteliale polmonare (ELF), espressa come rapporto delle concentrazioni ELF/plasma, è circa 55%/54% per IMI/REL, rispettivamente, suggerendo una ottima penetrazione di IMI/REL a livello polmonare (Tabella 1).

Trial registrativi ed esperienza real life
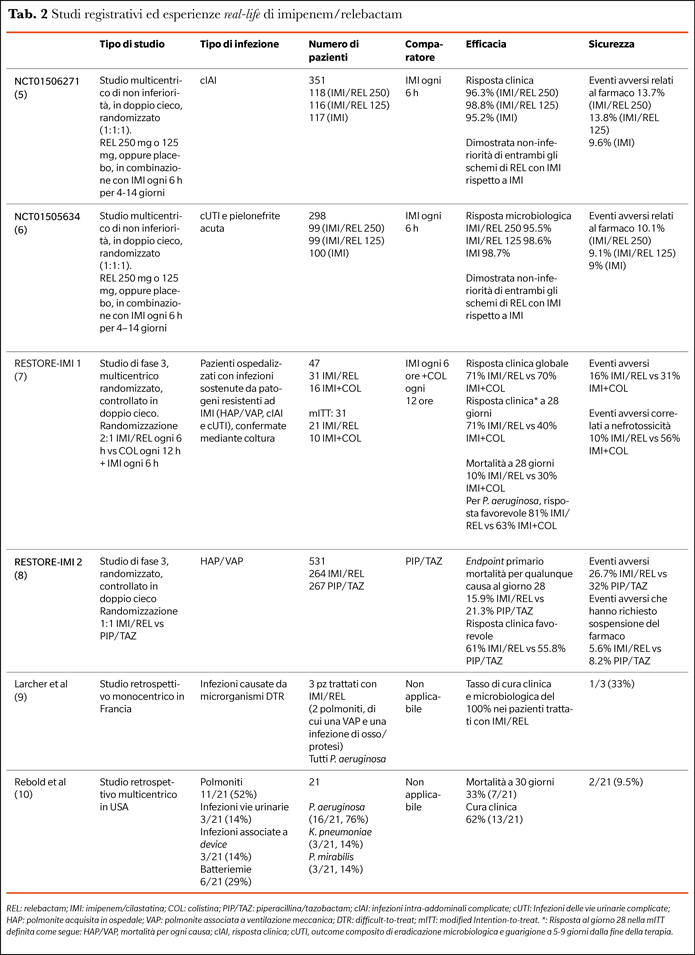
I trial registrativi di IMI/REL, gli studi RESTORE-IMI 1 e 2 e le esperienze real life al momento disponibili in letteratura sono mostrate in Tabella 2 (4-10). Nel loro insieme, i primi giustificano le indicazioni FDA/EMA, le seconde suggeriscono un possibile valido impiego per le infezioni sostenute da Enterobacterales KPC-produttrici e P. aeruginosa MDR.
Contributo alla terapia delle infezioni da Gram-negativi carbapenem-resistenti
L’ingresso nel mercato dei nuovi beta-lattamici/inibitori delle beta-lattamasi (BL/BLI) quali CAZ/AVI, ceftolozane/tazobactam (TOL/TAZ), meropenem/vaborbactam (MER/VAB) e IMI/REL ha sicuramente ampliato le possibilità di trattamento delle infezioni causate da batteri Gram-negativi carbapenem-resistenti. Infatti, i nuovi BL/BLIs rappresentano i farmaci di prima scelta per il trattamento delle infezioni causate da Enterobacterales KPC-produttrici (CAZ/AVI, MER/VAB e IMI/REL) e P. aeruginosa MDR (TOL/TAZ, CAZ/AVI e IMI/REL).
In questo contesto, IMI/REL possiede delle caratteristiche peculiari che lo potrebbero rendere preferibile, in specifiche condizioni, agli altri farmaci attualmente disponibili.
Infatti, sia IMI sia REL presentano una buona penetrazione a livello dell’ELF (≈50% delle concentrazioni plasmatiche), superiore a CAZ/AVI, simile a TOL/TAZ e lievemente inferiore rispetto a MER/VAB. Non sorprende quindi che, nello studio RESTORE-IMI2, IMI/REL abbia dimostrato la non inferiorità rispetto a piperacillina/tazobactam (PIP/TAZ) nel trattamento delle HAP/VAP, con dati incoraggianti sia per quanto riguarda la mortalità a 28 giorni (15.9% IMI/REL vs 21.3% PIP/TAZ) sia per la risposta clinica favorevole (61% IMI/REL vs 55.8% PIP/TAZ) (8). Allo stesso modo, nonostante la scarsa numerosità dei pazienti inclusi, nel sottogruppo delle HAP/VAP dello studio RESTORE-IMI1, che includeva infezioni causate da patogeni IMI non-suscettibili, IMI/REL era associato a una apparente maggiore risposta clinica e a una riduzione del 20% della mortalità a 28 giorni rispetto al gruppo di controllo (colistina+IMI) (7).
Pertanto, alla luce dell’attività in vitro e dell’adeguata penetrazione a livello polmonare, IMI/REL si configura come il farmaco di scelta insieme a MER/VAB per le infezioni respiratorie sostenute da Enterobacterales KPC-produttrici. Per le medesime ragioni, diventa una opzione di prima scelta insieme a TOL/TAZ quando in queste infezioni viene isolato P. aeruginosa MDR. Ovviamente, la contemporanea presenza dei suddetti agenti microbici a livello respiratorio renderebbe IMI/REL l’unica opzione valida in monoterapia.
Per quanto riguarda le infezioni intraddominali, che sono l’esempio più classico di infezione polimicrobica, la spiccata azione di IMI nei confronti di Enterococcus faecalis, aspetto che lo differenzia da CAZ/AVI, MER/VAB e TOL/TAZ, potrebbe rappresentare un elemento di scelta a favore di IMI/REL.
Infine, un ulteriore possibile utilizzo di IMI/REL risiede nelle infezioni da Enterobacterales KPC-produttrici resistenti sia a CAZ/AVI sia a MER/VAB, ma che sono spesso suscettibili a IMI/REL come conseguenza del minore effetto delle mutazioni della porina OmpK36 su IMI/REL. Tali infezioni sono state recentemente segnalate in ospedali italiani (3) e indicano l’importanza di includere, in queste circostanze, anche IMI/REL nei saggi di suscettibilità in vitro.
Conclusioni
IMI/REL, oltre a rappresentare un nuovo agente per le terapie delle cUTI/cIAI e delle HAP/VAP, possiede delle peculiari caratteristiche microbiologiche e di farmacocinetica che lo possono rendere particolarmente utile anche in casi di isolamento di Enterobacterales KPC-produttrici e P. aeruginosa MDR, ove già sono disponibili opzioni terapeutiche. Tuttavia, la mole di esperienza clinica non è ancora tale da consentire un giudizio definitivo sul farmaco: in tal senso, sarà importante fare tesoro dei casi clinici che verranno trattati nei prossimi primi mesi di impiego clinico per raccogliere ed analizzare nuovi dati per studi osservazionali.
- https://www.ema.europa.eu/en/documents/product-information/recarbrio-epar-product-information_it.pdf
- Papp-Wallace KM, Barnes MD, Alsop J, et al. Relebactam Is a Potent Inhibitor of the KPC-2 β-Lactamase and Restores Imipenem Susceptibility in KPC-Producing Enterobacteriaceae. Antimicrob Agents Chemother. 2018;62(6):e00174-18.
- Di Pilato V, Principe L, Andriani L, et al. Deciphering variable resistance to novel carbapenem-based β-lactamase inhibitor combinations in a multi-clonal outbreak caused by Klebsiella pneumoniae carbapenemase (KPC)-producing Klebsiella pneumoniae resistant to ceftazidime/avibactam. Clin Microbiol Infect. 2022:S1198-743X(22)00578-X.
- Yahav D, Giske CG, Gramatniece A, et al. New β-lactam–β-lactamase inhibitor combinations. Clin Microbiol Rev 2021;34:e00115-20.
- Lucasti C, Vasile L, Sandesc D, et al. Phase 2, Dose-Ranging Study of Relebactam with Imipenem-Cilastatin in Subjects with Complicated Intra-abdominal Infection. Antimicrob Agents Chemother. 2016;60(10):6234-43.
- Sims M, Mariyanovski V, McLeroth P, et al. Prospective, randomized, double-blind, Phase 2 dose-ranging study comparing efficacy and safety of imipenem/cilastatin plus relebactam with imipenem/cilastatin alone in patients with complicated urinary tract infections. J Antimicrob Chemother. 2017;72(9):2616-2626.
- Motsch J, Murta de Oliveira C, Stus V, et al. RESTORE-IMI 1: A Multicenter, Randomized, Double-blind Trial Comparing Efficacy and Safety of Imipenem/Relebactam vs Colistin Plus Imipenem in Patients With Imipenem-nonsusceptible Bacterial Infections. Clin Infect Dis. 2020;70(9):1799-1808.
- Titov I, Wunderink RG, Roquilly A, et al. A Randomized, Double-blind, Multicenter Trial Comparing Efficacy and Safety of Imipenem/Cilastatin/Relebactam Versus Piperacillin/Tazobactam in Adults With Hospital-acquired or Ventilator-associated Bacterial Pneumonia (RESTORE-IMI 2 Study). Clin Infect Dis. 2021;73(11):e4539-e4548.
- Larcher R, Laffont-Lozes P, Roger C, et al. Last resort beta-lactam antibiotics for treatment of New-Delhi Metallo-Beta-Lactamase producing Enterobacterales and other Difficult-to-Treat Resistance in Gram-negative bacteria: A real-life study. Front Cell Infect Microbiol. 2022;12:1048633.
- Rebold N, Morrisette T, Lagnf AM, et al. Early Multicenter Experience With Imipenem-Cilastatin-Relebactam for Multidrug-Resistant Gram-Negative Infections. Open Forum Infect Dis. 2021;8(12):ofab554.






