 Lo Streptococcus anginosus group (SAG), precedentemente gruppo S. milleri, è composto da tre specie di streptococchi viridanti: S. anginosus, S. intermedius e S. constellatus (1) che fanno parte della flora orofaringea, gastrointestinale e genitourinaria. Il loro isolamento è stato a lungo sottovalutato, sia per difficoltà tecniche dell’identificazione microbiologica che per la frequente coinfezione con altri microrganismi (2). Con la diffusione delle tecniche di biologia molecolare, sono stati riconosciuti come veri patogeni opportunisti (3), aventi un’incidenza stimata di malattia invasiva di 8.6-8.8/10.000 ospedalizzati (4).
Lo Streptococcus anginosus group (SAG), precedentemente gruppo S. milleri, è composto da tre specie di streptococchi viridanti: S. anginosus, S. intermedius e S. constellatus (1) che fanno parte della flora orofaringea, gastrointestinale e genitourinaria. Il loro isolamento è stato a lungo sottovalutato, sia per difficoltà tecniche dell’identificazione microbiologica che per la frequente coinfezione con altri microrganismi (2). Con la diffusione delle tecniche di biologia molecolare, sono stati riconosciuti come veri patogeni opportunisti (3), aventi un’incidenza stimata di malattia invasiva di 8.6-8.8/10.000 ospedalizzati (4).
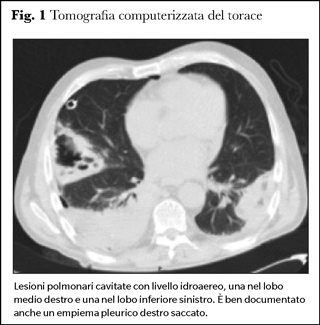
In seguito ad una lesione mucosale (spesso del cavo orale come gengiviti, periodontiti o ascessi) possono acquisire un fenotipo patogeno e generare infezioni tendenti alla propagazione sistemica (4). Dimostrano infatti una presentazione clinica aggressiva, denominata infezione piogenica disseminata, con multiple lesioni ascessuali coinvolgenti prevalentemente sistema nervoso centrale (SNC), fegato, polmone e milza (5) (Figure 1 e 2).
I batteri dello SAG sono spesso isolati da empiemi pleurici, ascessi cerebrali ed epatici (6), e da mediastiniti necrotizzanti discendenti secondarie a gravi infezioni odontogene come la angina di Ludwig (7). Infine, il loro isolamento dalle secrezioni respiratorie è stato osservato in condizioni di deterioramento della funzione respiratoria negli affetti da fibrosi cistica (6).
Caratteristiche cliniche
 Nonostante una certa eterogeneità degli studi clinici è possibile dare una caratterizzazione di questi patogeni: S. anginosus è l’isolato più frequente (55%) e sembra causare prevalentemente malattia gastrointestinale (maggiormente epatobiliare e appendicolare); S. constellatus (37%) infezioni respiratorie e di cute e tessuti molli; S. intermedius (8%) è associato alle infezioni del distretto testa-collo (inclusi gli ascessi cerebrali) (3).
Nonostante una certa eterogeneità degli studi clinici è possibile dare una caratterizzazione di questi patogeni: S. anginosus è l’isolato più frequente (55%) e sembra causare prevalentemente malattia gastrointestinale (maggiormente epatobiliare e appendicolare); S. constellatus (37%) infezioni respiratorie e di cute e tessuti molli; S. intermedius (8%) è associato alle infezioni del distretto testa-collo (inclusi gli ascessi cerebrali) (3).
In una casistica del 2012 S. intermedius rappresentava il 42% degli isolati e il coinvolgimento encefalico risultava pressocché costante (92%), derivando dall’estensione di un’infezione contigua (sinusite, mastoidite, infezione odontogena o di ferita neurochirurgica) o da disseminazione ematogena di un focolaio remoto (respiratorio o gastrointestinale) (5).
Issa e coll. hanno raccolto 101 casi di infezione da S. intermedius, evidenziando una degenza maggiore rispetto agli affetti da altri membri dello SAG. Gli ascessi (presenti nel 98% dei pazienti) erano a livello encefalico nel 41.6%, confermando la predilezione di S. intermedius per il SNC (6). Al Majid e coll. hanno esaminato 105 casi di infezione invasiva da SAG (senza identificazione di specie) e i quadri sindromici più frequenti erano infezioni di cute e tessuti molli (55%), ascessi intraddominali (24%), e ascessi polmonari con empiema (5%) (4).
In uno studio su 78 batteriemie da SAG gli apparati più coinvolti erano quello epatobiliare (32.1%), gastrointestinale (11.5%) e toracico (10.2%), mentre un’endocardite infettiva (EI) veniva diagnosticata solo nel 3.8% (1). Infatti, questo gruppo di patogeni mostra bassa propensione a causare EI rispetto alle altre specie streptococciche (4-5). In una raccolta di 5336 casi di EI, solo 72 (1.4%) erano causate da SAG (55% da S. anginosus), e riguardavano prevalentemente il genere maschile (76%) e la valvola aortica (40.3%). Confrontati con 144 casi di EI da Streptococchi viridanti o S. gallolyticus, non emergevano significative differenze in termini di complicanze, indicazioni chirurgiche o prognosi (8).
Il 35-45% delle infezioni da SAG risultano polimicrobiche con riscontro in particolare di Streptococchi viridanti, anaerobi, Enterobacterales ed una peculiare presenza di Eikenella corrodens (1, 2, 4). I quadri polimicrobici sono associati a maggior rischio di ascessualizzazione, infezione intraddominale e decesso (4).
Le infezioni da SAG hanno anche una rilevanza pediatrica. Ismail e coll. hanno analizzato retrospettivamente 200 individui con età mediana di 12 anni e sede primaria di infezione prevalentemente addominale (39%), dei tessuti molli (36%) e del distretto testa-collo (21%). S. intermedius (27% degli isolati) si confermava maggiormente associato al distretto testa-collo, mentre S. anginosus (39%) e S. constellatus (34%) alle infezioni intraddominali (9).
Popolazione coinvolta e fattori di rischio
È comune la presenza di fattori di rischio che predispongono alla malattia da SAG. I fattori più comunemente riscontrati sono il diabete mellito e le neoplasie (4-5), cui si aggiungono le malattie croniche intestinali, l’insufficienza renale cronica e le patologie della regione testa-collo come infezioni odontogene e sinusiti (6). Nel lavoro di Suzuki e coll. il 32.1% dei pazienti era affetto da neoplasia maligna e gli Autori hanno ipotizzato che l’alterazione anatomica data dal tumore avesse causato un’infezione localizzata, successivamente disseminatasi (1). Inoltre, sembrano associate anche la chirurgia bariatrica, la malattia diverticolare, le malattie neurologiche, le varici esofagee e l’appendicectomia recente (3). Sebbene non clinicamente giustificata, viene spesso documentata una moderata prevalenza maschile (52%-83%) (1, 4-6, 9).
Gestione e prognosi
Non sono disponibili linee guida sulla gestione delle infezioni invasive da patogeni appartenenti allo SAG. Data la difficile penetrazione antibiotica nelle cavità ascessuali, in particolare quelle encefaliche, il drenaggio chirurgico viene considerato indispensabile per il corretto trattamento. Circa il 90% dei casi necessita di una gestione combinata medico-chirurgica (4, 6, 9).
Ad ogni modo, queste specie streptococciche mantengono generalmente un’ottima sensibilità verso gli antibiotici β-lattamici con quasi il 100% degli isolati penicillino-sensibili (1, 5). Sebbene di rado, sono stati descritti casi di resistenza a daptomicina acquisita in corso di trattamento (5). Uno studio in vitro su 190 isolati di SAG ha riportato che il 100% era suscettibile a penicillina, ampicillina, ceftriaxone, vancomicina e teicoplanina. La resistenza a gentamicina era del 60.5%, a tetracicline 5.8%, rifampicina 5.3%, ciprofloxacina 1.1% (2). Fluorochinoloni e macrolidi solitamente non vengono consigliati perché la resistenza sembra di facile sviluppo e in progressivo incremento (1).
Va considerato che l’elevata incidenza di infezioni polimicrobiche influenza pesantemente la scelta del trattamento. Oltre il 90% dei pazienti ha ricevuto un trattamento costituito da un backbone β-lattamico, principalmente penicilline o cefalosporine, combinato nel 50% con cloramfenicolo, metronidazolo, clindamicina, meropenem, vancomicina o rifampicina (5-6). Dalbavancina, un lipoglicopeptide long-acting di nuova generazione, ha dimostrato in vitro una potente attività battericida sui 211 ceppi di SAG, con MIC 32-256 volte inferiori rispetto alla vancomicina e 8-128 volte rispetto a daptomicina (10).
La durata del trattamento va calibrata considerando l’estensione del processo infettivo, la severità delle condizioni del paziente e la disponibilità di una pronta bonifica chirurgica. Classicamente, in infezioni disseminate e/o con focolai multipli ascessuali in fegato, polmone e cervello, il trattamento antibiotico viene protratto per non meno di 6 settimane (5-6), sebbene casistiche più recenti descrivano durate medie di 14-21 giorni, soprattutto quando risulta possibile ed efficiente il drenaggio chirurgico (1, 9).
La mortalità complessiva delle infezioni da patogeni dello SAG varia dal 5.5% al 17% (1, 4-). Suzuki e coll. giustificano una mortalità intraospedaliera del 14.1% specificando che la maggior parte dei deceduti era affetto da neoplasia in fase avanzata (1). La presenza di batteriemia da SAG, l’età maggiore di 65 anni ed una neoplasia sono fattori di rischio di mortalità (4). All’interno della popolazione pediatrica presentata da Ismail e coll. non vengono registrati decessi, ma il 23% richiede nuova ospedalizzazione (prevalentemente per recidiva di ascessi) e il 15% nuova chirurgia. Questo potrebbe però essere attribuibile ad eccessiva brevità del trattamento antibiotico (mediana 9 giorni) (9).
Conclusioni
I microrganismi dello Streptococcus anginosus group, sebbene parte della nostra flora commensale, possono comportarsi, soprattutto in pazienti con comorbidità rilevanti, come patogeni altamente aggressivi e capaci di causare una sindrome sistemica che sottende una significativa mortalità. Al fine di migliorare l’outcome dei pazienti affetti è necessaria una maggiore consapevolezza della rilevanza clinica di questi patogeni, dei principali fattori di rischio associati e della necessità di una gestione integrata medico-chirurgica.
- Suzuki H, Hase R, Otsuka Y, et al. Bloodstream infections caused by Streptococcus anginosus group bacteria: A retrospective analysis of 78 cases at a Japanese tertiary hospital. J Infect Chemother. 2016;22(7):456-460.
- Kaplan NM, Khader YS, Ghabashineh DM. Laboratory Diagnosis, Antimicrobial Susceptibility And Genuine Clinical Spectrum of Streptococcus anginosus Group; Our Experience At A University Hospital. Med Arch. 2022;76(4):252-258.
- Pilarczyk-Zurek M, Sitkiewicz I, Koziel J. The Clinical View on Streptococcus anginosus Group - Opportunistic Pathogens Coming Out of Hiding. Front Microbiol. 2022;13:956677.
- Al Majid F, Aldrees A, Barry M, et al. Streptococcus anginosus group infections: Management and outcome at a tertiary care hospital. J Infect Public Health. 2020;13(11):1749-1754.
- Giuliano S, Rubini G, Conte A, et al. Streptococcus anginosus group disseminated infection: case report and review of literature. Infez Med. 2012;20(3):145-154.
- Issa E, Salloum T, Tokajian S. From Normal Flora to Brain Abscesses: A Review of Streptococcus intermedius. Front Microbiol. 2020;11:826.
- Sakai T, Sano A, Azuma Y, et al. Streptococcus anginosus group infection as a predictor for the progression of descending necrotizing mediastinitis. Ann Palliat Med. 2021;10(4):4008-4016.
- Escrihuela-Vidal F, López-Cortés LE, Escolà-Vergé L, et al. Clinical Features and Outcomes of Streptococcus anginosus Group Infective Endocarditis: A Multicenter Matched Cohort Study. Open Forum Infect Dis. 2021;8(6):ofab163.
- Sader HS, Streit JM, Mendes RE. Update on the in vitro activity of dalbavancin against indicated species (Staphylococcus aureus, Enterococcus faecalis, β-hemolytic streptococci, and Streptococcus anginosus group) collected from United States hospitals in 2017-2019. Diagn Microbiol Infect Dis. 2021;99(1):115195.
- Ismail K, Hughes I, Moloney S, et al. Streptococcus anginosus group infections in hospitalised children and young people. J Paediatr Child Health. 2022;58(5):809-814.






