Sono in uso da quasi 20 anni farmaci antivirali efficaci ad alta barriera genetica contro l’epatite B. L’entecavir ed il tenofovir (1) interrompono la sintesi del genoma da parte della polimerasi del virus dell’epatite B (HBV), generando catene abortive di DNA virale; in oltre il 90% dei pazienti trattati riducono progressivamente l’HBV-DNA sierico a livelli indeterminabili od appena determinabili, con ottimo profilo di tolleranza. Rappresentano opzione terapeutica per la gran parte dei pazienti con epatopatia cronica B compensata e scompensata, per la profilassi della recidiva post-trapianto, e per la riacutizzazione dell’infezione; a gioco lungo diminuiscono la fibrosi epatica, migliorando l’ipertensione portale (2,3). Pur consentendo un eccellente controllo clinico, gli antivirali convenzionali non riescono ad eliminare l’HBsAg, per cui alla loro sospensione la viremia e la malattia il più spesso si riattivano, e nella maggior parte dei pazienti essi devono essere dati per tempo indefinito. Un tema caldo è l’identificazione di marcatori sierologici che permettano di identificare i pazienti HBsAg-positivi non cirrotici che rimarranno in remissione una volta sospesa la terapia (4). Gli antivirali convenzionali, inoltre, non aboliscono il rischio dell’insorgenza dell’epatocarcinoma che persiste nei cirrotici anche in buon controllo clinico.
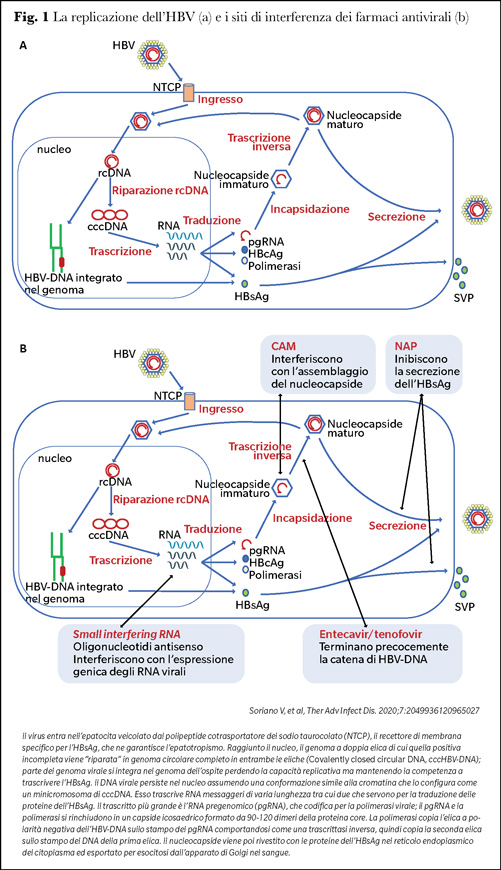 Il ruolo negativo dell’HBsAg ha portato a definire una nuova modalità di terapia dell’HBV, la cosiddetta cura funzionale (5). Per comprenderne gli obiettivi è necessario riferirsi al meccanismo replicativo dell’HBV (6) (Figura 1).
Il ruolo negativo dell’HBsAg ha portato a definire una nuova modalità di terapia dell’HBV, la cosiddetta cura funzionale (5). Per comprenderne gli obiettivi è necessario riferirsi al meccanismo replicativo dell’HBV (6) (Figura 1).
Poiché il minicromosoma e l’HBV-DNA integrato sono inaccessibili all’attacco farmacologico, non è attuabile terapia sterilizzante che richiederebbe farmaci capaci di degradarli; il cccDNA virale non eliminabile mantiene attività trascrizionale per gli intermedi replicativi di HBV (incluso l’HBsAg) malgrado ogni tentativo terapeutico (7).
La cura funzionale rappresenta un compromesso, proponendosi di indurre in un tempo finito di trattamento l’eliminazione sostenuta dell’HBsAg circolante oltre che dell’HBV. La clearance dell’HBsAg dal sangue corrisponderebbe a marcata soppressione della replicazione dell’HBV; il virus non recidiva alla sospensione degli antivirali, si riduce il rischio di epatocarcinoma, l’individuo non può più contagiare e si libera dello stigma socialmente invalidante di portatore di HBsAg.
Tuttavia l’intensa e diversificata ricerca degli ultimi 10 anni non è finora approdata ad un risultato clinico concreto per cui rimane incerta la reale prospettiva sul campo della cura funzionale.
Il ciclo dell’HBV offre più punti d’attacco a nuove molecole antivirali; le più idonee a inibire la sintesi dell’HBV e dell’HBsAg dovrebbero essere i modulatori dell’assemblaggio del capside virale (Capsid assembly modulators - CAM) e le terapie basate sugli acidi nucleici (8,9).
Capsid assembly modulators
I CAM vengono somministrati per bocca. Bloccano la sintesi virale interferendo con l’assemblaggio del nucleocapside e l’incapsidazione del pgRNA; la proteina del core è un obiettivo sensibile in quanto costituisce la pietra costitutiva dell’involucro genetico dell’HBV ed indirettamente regola vari passi del ciclo virale sfruttando le proteine dell’ospite (10,11). Attività antivirale dei CAM è stata dimostrata sia nel modello cellulare che in vivo. Sono in fase 2 di studio clinico vari farmaci (5,12) fra cui ABI-HO73 che induce la formazione di particelle virali vuote, JNJ 56136379 che accelera l’assemblaggio del core risultando in un nucleocapside senza materiale genomico, RO7049389 che dimostra decisa capacità nell’inibire l’HBV-DNA; sono in fase preclinica ALG-000184, GLS4JHS, EDP-514, GLP-26, ABI-H3733.
I CAM sono capaci nell’immediato di indurre marcata inibizione dell’HBV-DNA riducendo sostanzialmente l’HBsAg circolante ma la replicazione virale ritorna rapidamente ai valori pre-terapia dopo la sospensione della cura (12,13). Un beneficio clinico dei CAM richiederebbe molti mesi, probabilmente anni di terapia; alcuni sono stati associati ad epatotossicità. L’ultimo nato, JNJ-56136379, studiato in un’ampia corte di 232 pazienti con epatite cronica B, ha dimostrato riduzione pronunciata dell’HBV-DNA e dell’HBV-RNA ma declino limitato dell’HBsAg e dell’HBeAg (nei pazienti che esprimevano quest’ultimo antigene) (14); pur ben tollerato, non ne è emerso chiaro beneficio in termini di efficacia clinica.
La percezione attuale è dunque che l’uso dei CAM, da soli od in combinazione con antivirali convenzionali, è incapace di ottenere una cura funzionale, che per definizione dovrebbe essere raggiunta dopo relativamente breve terapia.
Acidi nucleici
Le terapie basate sugli acidi nucleici includono gli small interfering RNA a doppia elica di 21-23 nucleotidi (siRNAs) e gli oligonucleotidi antisenso a singola elica di 8-10 nucleotidi; sono somministrati per via sottocutanea (5,12,13).
Bloccano l’espressione genica dell’HBsAg, sia dai messaggeri RNA del cccDNA che dalle sequenze virali integrate, riducendo la concentrazione dell’antigene nel sangue; poiché l'eccesso di HBsAg circolante distrae dalla sua funzione il sistema immune costituendo un’esca che neutralizza gli anticorpi anti-HBs, un ulteriore potenziale vantaggio della riduzione delle particelle HBsAg subvirali potrebbe essere la riattivazione delle risposte immuni specifiche contro l’HBV (15). Gli acidi nucleici riducono l’HBsAg in proporzione al numero di inoculazioni, ma la riduzione dell’antigene raggiunge un plateau dopo qualche settimana. L’inibizione dell’HBsAg si mantiene per alcuni mesi dopo la sospensione della terapia ma poi l’antigene circolante risale; gli oligonucleotidi antisenso sono stati associati ad aumenti importanti degli enzimi epatici. Anche queste terapie richiederebbero molti mesi o anni per validarne l’efficacia e la sicurezza, contravvenendo l’assunto di un tempo limitato di terapia che è la premessa della cura funzionale.
Nel tentativo di ristabilire la risposta immune contro l’HBV, di base deficitaria nei pazienti con l’infezione cronica virale, sono stati proposti vari tentativi per restaurare la reattività immunologica individuale (16); tuttavia né vaccini terapeutici mirati a potenziare le risposte dei linfociti T e B, né terapie immunomodulanti mirate a ricostituire la riposta immunologica innata o quella delle cellule B (17,18) hanno portato a risultati clinici concreti.
Una considerazione a parte meritano i polimeri degli acidi nucleici (NAP) il cui meccanismo d’azione è diverso dai CAM e dagli acidi nucleici; si ritiene che riducano l’espressione dell’HBsAg bloccando la formazione ed il rilascio delle particelle subvirali di HBV; l’HBsAg non si accumulerebbe nelle cellule perché eliminato per degradazione proteosomiale e lisosomiale (19).
In uno studio, dopo 24 settimane iniziali di monoterapia con tenofovir, la somministrazione per via parenterale per 48 settimane dei NAP REP 2139 o REP 2165 insieme al pegIFN alfa ha indotto nel 44% di 40 pazienti con epatite cronica B la perdita dell’HBsAg. Il 39% rientrava nei criteri di una cura funzionale dopo 24 settimane dalla sospensione dei farmaci (20); sono state segnalate riaccensioni importanti delle ALT durante la terapia. Pur promettenti, i dati sui NAP sono stati finora raccolti in pochi pazienti in studi monocentrici ed attendono conferma da più estesi studi multicentrici.
Conclusioni
La cura funzionale dell’infezione dell’HBV appare in stallo. L’eliminazione sostenuta dell’HBsAg e dell’HBV-DNA circolanti con terapia limitata nel tempo s’è rivelata obiettivo troppo ambizioso; i risultati finora ottenuti sono parziali e temporanei ed un loro beneficio rimane al momento dubbio. Difficoltà maggiori sono l’impossibilità ad usare appropriati parametri clinici, e la mancanza di sensibili endpoint virologici, al di là della soglia attuale di determinazione nel sangue dell’HBsAg (0.05 unità internazionali /mL) e dell’HBV-DNA (10 unità internazionali/mL); la determinazione dell’Hepatitis B core-related antigen (HBcrAg) e dell’HBV-RNA, considerati surrogati misurabili della quantità e dell’attività replicativa del cccDNA, non ha fornito parametri consistenti (13).
La cura funzionale dovrà dunque essere ricalibrata con obiettivi più realistici, soprattutto nei tempi di terapia, ben più lunghi di quanto proposto nella formulazione originale. Viene a questo punto da chiedersi se l’impresa vale la spesa.
Il successo della terapia eradicante contro l’HCV ed i profitti che ne sono venuti hanno indotto l’industria farmaceutica ad investire nei nuovi farmaci anti-HBV, nell’assunto di un bacino d’utenza di milioni di pazienti con epatite B analogo all’utenza originale dell’epatite C. Tuttavia lo scenario epidemiologico dell’HBV è diverso nei Paesi ad alto reddito come l’Italia; l’utenza dell’epatite C si distribuiva in tutti i Paesi compresi quelli più ricchi, ma in quest’ultimi la vaccinazione universale contro l’epatite B, introdotta dall’inizio degli anni '90, ha drammaticamente ridotto la circolazione dell’HBV e la ridurrà ulteriormente negli anni a venire; in Italia i soggetti d’età fino a quarant’anni sono ora protetti dall’infezione.
Considerato che verosimilmente saranno ancora necessari più anni prima che la cura funzionale possa eventualmente diventare una realtà clinica, la diminuzione del potenziale mercato a fronte dei formidabili ostacoli biologici della ricerca e dei costi crescenti potrebbe scoraggiare l’investimento ulteriore da parte dell’industria farmaceutica. D’altro canto, le residue coorti senescenti di pazienti domestici con infezione cronica da HBV potranno verosimilmente restare in tranquillo controllo con gli antivirali attuali. Per cui saranno in pochi a giovarsi dei nuovi farmaci; ma con quali reali vantaggi, con quali costi e quali rischi rispetto al controllo clinico e la sicurezza garantiti da entecavir e da tenofovir?
È vero che nel mondo occidentale ricompaiono le infezioni da HBV negli immigrati e che milioni di soggetti infetti dall’HBV residuano nelle aree più povere dell’Africa e dell’Asia; tuttavia, considerati i problemi sociali, sanitari, logistici e le risorse limitate, quanti saranno realisticamente i pazienti raggiungibili e trattabili con le nuove sofisticate terapie e con quale copertura economica rispetto a entecavir e tenofovir ora disponibili come generici a basso costo in tutto il mondo?
- Lampertico P, Agarwal K, Berg T, et al. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-98.
- Chang TT, Liaw YF, Wu SS, et al. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology 2010;52:886-93.
- Marcellin P, Gane E, Buti M, et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013;381:468-75.
- Tout I, Lampertico P, Berg T, Asselah T. Perspectives on stopping nucleos(t)ide analogues therapy in patients with chronic hepatitis B. Antiviral Res. 2021;185:104992.
- Wong GLH, Gane E, Lok ASF. How to achieve functional cure of HBV: Stopping NUCs, adding interferon or new drug development? J Hepatol. 2022;7:1249-1262.
- Beck J, Nassal M. Hepatitis B virus replication. World J Gastroenterol. 2007;13:48-64.
- Martinez MG, Boyd A, Combe E, et al. Covalently closed circular DNA: the ultimate therapeutic target for curing HBV infections. J Hepatol. 2021;75:706-717.
- Levrero M, Pollicino T, Petersen J, et al. Control of cccDNA function in hepatitis B virus infection. J Hepatol. 2009;51:581-592.
- Taverniti V, Ligat G, Debing Y, et al. Capsid assembly modulators as antiviral agents against HBV: molecular mechanisms and clinical perspectives. J Clin Med. 2022;11:1349.
- Kim H, Ko C, Lee JY, Kim M. Current progress in the development of hepatitis B virus capsid assembly modulators: chemical structure, mode-of-action and efficacy. Molecules 2021; 26: 7420.
- Diab A, Foca A, Zoulim F, et al. The diverse functions of the hepatitis B core/capsid protein (HBc) in the viral life cycle: implications for the development of HBc-targeting antivirals. Antivir. Res. 2018;149: 211-220.
- Zoulim F, Testoni B. Eliminating cccDNA to cure hepatitis B virus infection. J Hepatol. 2023;78:677-680.
- Pawlotsky JM. New hepatitis B drug development disillusions: time to reset? Lancet Gastroenterol Hepatol. 2023;8:192-197.
- Janssen HLA, Hou J, Asselah T, et al. Randomised phase 2 study (JADE) of the HBV capsid assembly modulator JNJ-56136379 with or without a nucleos(t)ide analogue in patients with chronic hepatitis B infection. Gut. 2023 Jan 25:gutjnl-2022-328041.
- Burton AR. Restoring, releasing or replacing adaptive immunity in chronic hepatitis B. Nat Rev Gastroenterol Hepatol. 2019;16:662-675.
- Boni C, Barili V, Acerbi G, et al. HBV immune-therapy: from molecular mechanisms to clinical applications. Int J Mol Sci. 2019;20:2754.
- Lebosse F, Testoni B, Fresquet J, et al. Intrahepatic innate immune response pathways are downregulated in untreated chronic hepatitis B. J Hepatol. 2017;66:897-909.
- Bertoletti A, Ferrari C. Adaptive immunity in HBV infection. J Hepatol. 2016;64:S71-S83.
- Boulon R, Blanchet M, Lemasson M, et al. Characterization of the antiviral effects of REP 2139 on the HBV lifecycle in vitro. Antiviral Res. 2020;183:104853.
- Bazinet M, Pântea V, Placinta G, et al. Safety and efficacy of 48 weeks REP 2139 or REP 2165, tenofovir disoproxil, and pegylated interferon alfa-2a in patients with chronic HBV infection naive to nucleos(t)ide therapy. Gastroenterology. 2020;158:2180-94.






