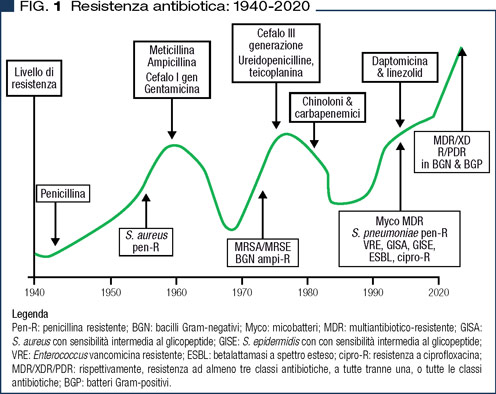
Le infezioni batteriche rappresentano uno degli aspetti più straordinariamente mutevoli in una patologia, quella infettiva, già di per sé in continua evoluzione. Di fatto uno degli elementi che ne sono alla base è la ormai quasi secolare contrapposizione tra gli agenti batterici e gli antibiotici: infatti, come mostra la Figura 1, la resistenza agli antibiotici esisteva ben prima che questi farmaci fossero introdotti in terapia. Nel grafico sono esposti da una parte gli antibiotici sviluppati dall’industria ed immessi in commercio, dall’altra parte il loro effetto solo transitorio sulla riduzione della resistenza antibiotica per l’emergenza di volta in volta di nuovi microrganismi resistenti. …E da ultimo pare che non solo stiano vincendo i “cattivi” ma anche che, a dispetto di tutti gli sforzi dell’industria farmaceutica, mai si è giunti al disotto del primissimo livello di resistenza antibiotica: appare evidente un certo grado di fallimento.
Nuovi patogeni emergenti
A corroborare quanto suddetto, nella Tabella 1 si riassumono i patogeni emersi in tempi anche recenti nel segno della resistenza antibiotica. Alcuni esempi tra i Gram-positivi: i nuovi Corynebacterium (C. jeikeium, agenti di batteriemie su “devices” intravascolari, C. striatum, agente di polmoniti nosocomiali, C. urealyticum, agente della “cistite crostosa”) hanno uno spettro di sensibilità agli antibiotici simile a MRSA (1), o gli enterococchi dopo l’alta resistenza agli aminoglicosidi, ora presentano anche ceppi dotati di una subdola forma di resistenza in vitro alla penicillina, ma non ampicillina, che però di fatto rende meno efficiente la terapia con betalattamina (2).
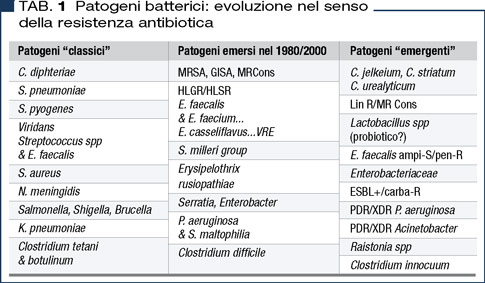
Infine l’emergenza di Clostri-dium innocuum, patogeno vancomicina-resistente, che va sospettato quando una sindrome di colite pseudomembranosa risulta negativa al test per Clostridium difficile (3).
Più consistenti, specialmente negli ospedali italiani, le varie forme di multiantibiotico-resistenza tra i Gram-negativi sia fermentanti, quali Klebsiellapneumoniae, Escherichia coli, Enterobacter (mediate prevalentemente sia da enzimi idrolizzanti betalattamine e carbapenem), che non fermentanti, quali Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltopihlia, e le emergenti Ralstonia species.
Evoluzione farmacologica
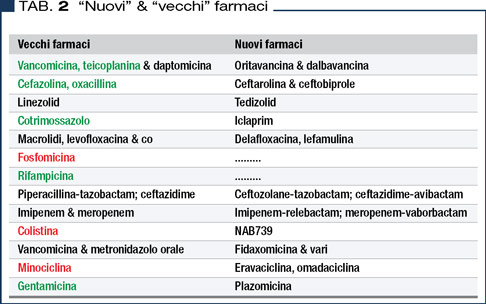
Va da sé che in questo contesto così mutevole l’armamentario antibatterico si è sempre dotato di nuovi farmaci come mostra sia la Figura 1 che la Tabella 2. Quest’ultima elenca vecchi e nuovi antibiotici disponendoli per appartenenza di classe (ad esempio eravaciclina e omadaciclina rappresentano l’evoluzione della “vecchia” minociclina) o per analogia di uso (ad esempio, fidaxomicina rappresenta un nuovo farmaco topico per la terapia della colite da C. difficile). Nella stessa Tabella 2 i vecchi farmaci sono riportati con vari colori. In nero (come i nuovi farmaci) sono riportati alcuni antibiotici il cui brevetto è scaduto più (linezolid, daptomicina) o meno (alcuni macrolidi, levofloxacina, carbapenem) recentemente. In verde sono riportati altri farmaci “sempre verdi” in quanto nel tempo non è venuta meno la loro principale indicazione.
La scelta dei farmaci
n Tra questi, oxacillina e cefazolina rimangono i farmaci di prima scelta per le infezioni gravi da Staphylococcus aureus meticillino sensibile: il primo antibiotico sembrerebbe più attivo in senso battericida (da preferire, quindi, per le endocarditi), il secondo è meno nefrotossico. Di fatto, però, recenti osservazioni da studi retrospettivi sembrano dimostrare una pari efficacia clinica tra le due betalattamine antistafilococche.
Uno studio prospettico randomizzato potrebbe chiarire se è reale questa pari efficacia: così fosse, cefazolina si farebbe preferire per la più semplice modalità di somministrazione e la più facile disponibilità per le farmacie (oxacillina spesso non è reperibile sul mercato).
n Allo stesso modo “sempre verdi” sono vancomicina e teicoplanina: la prima si fa preferire rispetto alla seconda per le infezioni intravascolari (rimane intatto il ruolo di vancomicina nelle relative Linee guida internazionali); la seconda conserva ancora intatto un ruolo importante soprattutto per le infezioni di ossa ed articolazioni per la possibilità di trattamenti extra-ospedaliero che offre la sua lunga emivita.
n Cotrimossazolo conserva ancora un ruolo per le infezioni acute della cute per la sua intatta attività antistafilococcica (incluso MRSA): sembra però aver perso un po’ della sua attività verso Stenotrophomonas maltophilia ma è una buona notizia la segnalazione recente che levofloxacina ne rappresenterebbe un’alternativa altrettanto valida (5, 6). In tal senso, sia cotrimossazolo che levofloxacina sono i farmaci di scelta nei confronti di Ralstonia species, bacilli Gram-negativi non fermentanti emergenti, anche questi intrinsecamente carbapenem resistenti (7).
n “Sempre verde” è anche minociclina: questa tetraciclina presenta tutt’oggi una rilevante attività anti stafilococcica, incluso MRSA, con attività anche nel biofilm: è quindi tuttora attuale il suo impiego, in associazione con rifampicina, nella terapia orale per le infezioni su corpo estraneo. Ma minociclina ha anche una interessante attività sia verso Acinetobacter baumanii complex carbapenem resistente che verso Stenorophomonas maoltophilia che ha incoraggiato lo sviluppo e l’impiego, apparentemente soddisfacente, (al momento solo in negli Stati Uniti) della formulazione endovenosa (8, 9).
Di interesse la recente descrizione di un sinergismo tra minociclina a azitromicina (altro “grande vecchio”!) in vitro e nel modello sperimentale di polmonite da Acinetobacter carbapenem resistente (10). Infine, se per rifampicina rimangono intatte tutte le sue indicazioni di farmaco di associazione per le infezioni tubercolari o stafilococciche su corpo estraneo, gentamicina ha perso parte del suo lustro nella combinazione classica anti-enterococcica con ampicillina per l’adozione della combinazione sinergica e meno nefrotossica ampicillina-ceftriaxone. Tale farmaco tuttavia, in virtù della sua concentrazione urinaria e della discreta attività anche nei confronti di enterobacteriaceae ESBL produttrici e/o carbapenem resistenti, sta ricevendo una significativa considerazione come terapia carbapenem sparing delle relative infezioni urinarie comunitarie e nosocomiali (11).
Farmaci “antichi” riscoperti
Nella Tabella 2 sono riportati in rosso colistina e fosfomicina, farmaci “antichi”, addirittura usciti di commercio in molte nazioni, ma recentemente riscoperti per il crescente fenomeno della carbapenem resistenza.
n Di colistina si è dovuto ristudiare la farmacocinetica per un soddisfacente impiego endovenoso e per ridurne la nefrotossicità (ad esempio associando la vitamina C) e l’eventuale maggiore efficacia di una terapia di combinazione: su questo ultimo aspetto vi è tuttavia ancora controversia. Dati i problemi di scarsa tollerabilità e i limiti farmacocinetici (penetrazione subottimale nel tessuto polmonare e nel liquor cefalorachidiano) è auspicabile una sostituzione con impiego dei nuovi farmaci betalattamici come ceftazidime-avibactam, meropenem-vaborbactam o cefiderocol.
n Infine fosfomicina, antibiotico fosfonico con meccanismo di azione simile alle betalattamine, è rimasta eterna incompiuta nonostante lo spettro di azione che include Gram-positivi (incluso MRSA) e Gram-negativi (incluse enterobactriaceae carbapenem resistenti) perché in monoterapia seleziona facilmente mutanti resistenti (13). Di questo farmaco tuttavia si riconosce oggi il frequente sviluppo in vitro di sinergismo con pressochè tutte le molecole verso vari microrganismi multiantibiotico-resistenti: con i glicopeptidi verso MRSA, con colistina o ceftazidime-avibactam verso varie specie Gram-negative carbapenem resistenti, con amikacina verso Pseudomonas aeruginosa.
In tal senso l’adozione di dosaggi fino a 24-36 gr/die in terapia di combinazione per le infezioni gravi sembra fornire risultati incoraggianti che, però, necessitano di una definitiva validazione (13).
Bibliografia
- Campanile F, Carretto E, Barbarini D, et al. Clonal multidrug-resistant Corynebacterium striatum strains, Italy. Emerg Infect Dis. 2009; 15:75-8.
- Kim D, Lee H, Yoon EJ, et al. Prospective observational study of the clinical prognoses of patients with bloodstream infections caused by ampicillin-susceptible but penicillin-resistant Enterococcus faecalis. Antimicrob Agents Chemother. 2019; 63(7). pii:e00291-19.
- Chia JH, Wu TS, Wu TL, et al. Clostridium innocuum is a vancomycin-resistant pathogen that may cause antibiotic-associated diarrhoea. Clin Microbiol Infect. 2018; 24(11):1195-1199.
- Karchmer AW. Definitive Treatment for Methicillin-Susceptible Staphylococcus aureus Bacteremia: Data Versus a Definitive Answer? Clin Infect Dis. 2017; 65:100-106.
- Gajdács M, Urban E. Prevalence and Antibiotic Resistance of Stenotrophomonas maltophilia in Respiratory Tract Samples: A 10-Year Epidemiological Snapshot. Health Serv Res Manag Epidemiol. 2019; Aug 15; 6:2333392819870774.
- Ko JH, Kang CI, Cornejo-Juárez P, et al. Fluoroquinolones versus trimethoprim-sulfamethoxazole for the treatment of Stenotrophomonas maltophilia infections: a systematic review and meta-analysis. Clin Microbiol Infect. 2019; 25:546-554.
- Basso M, Venditti C, Raponi G, et al. A case of persistent bacteraemia by Ralstonia mannitolilytica and Ralstonia pickettii in an intensive care unit. Infect Drug Resist. 2019; 2:2391-2395.
- Flamm RK, Shortridge D, Castanheira M, et al. In Vitro Activity of Minocycline against U.S. Isolates of Acinetobacter baumannii-Acinetobacter calcoaceticus species complex, Stenotrophomonas maltophilia, and Burkholderia cepacia complex: Results from the SENTRY Antimicrobial Surveillance Program (2014-2018). Antimicrob Agents Chemother. 2019; Aug 19. pii:AAC.01154-19 [Epub ahead of print].
- Fragkou PC, Poulakou G, Blizou A, et al. The Role of Minocycline in the Treatment of Nosocomial Infections Caused by Multidrug, Extensively Drug and Pandrug Resistant Acinetobacter baumannii: A Systematic Review of Clinical Evidence. Microorganisms. 2019; 7(6). pii:E159.
- Dillon N, Holland M, Tsunemoto H, et al. Surprising synergy of dual translation inhibition vs. Acinetobacter baumannii and other multidrug-resistant bacterial pathogens. EBioMedicine. 2019; 46:193-201.
- Wie SH, Kim HW, Chang UI. Effects of gentamicin monotherapy for the initial treatment of community-onset complicated non-obstructive acute pyelonephritis due to Enterobacteriaceae in elderly and non-elderly women. Clin Microbiol Infect. 2014; 20(11):1211-8.
- Dalfino L, Puntillo F, Mosca A, et al. High-dose, extended-interval colistin administration in critically ill patients: is this the right dosing strategy? A preliminary study. Clin Infect Dis. 2012; 54(12):1720-6.
- Múñez Rubio E, Ramos Martínez A, Fernández Cruz A. Fosfomycin in antimicrobial stewardship programs. Rev Esp Quimioter. 2019; 32 Suppl 1:62-66.






