.jpg) Le janus kinasi (JAK) sono una famiglia di tirosin kinasi (JAK1; JAK2; JAK3; TyK2) che risiedono sulla porzione intracitoplasmatica dei recettori di numerose citochine. Il legame citochina-recettore determina, tramite JAK, la fosforilazione della coda citoplasmatica del recettore stesso e attiva a valle, la via metabolica di trasduzione e, quindi, di trascrizione del segnale (STAT: signal transducer and activator of transcription) (Figura 1) (1).
Le janus kinasi (JAK) sono una famiglia di tirosin kinasi (JAK1; JAK2; JAK3; TyK2) che risiedono sulla porzione intracitoplasmatica dei recettori di numerose citochine. Il legame citochina-recettore determina, tramite JAK, la fosforilazione della coda citoplasmatica del recettore stesso e attiva a valle, la via metabolica di trasduzione e, quindi, di trascrizione del segnale (STAT: signal transducer and activator of transcription) (Figura 1) (1).
JAK1 e JAK3 sono associate ai recettori di citochine essenziali per la funzione T linfocitaria (IL2, IL4, IL7, IL9, IL15, IL21). L’inibizione di JAK1 e JAK3 limita l’espansione delle cellule T helper e la differenziazione in senso TH1 e TH17; compromette la funzione delle cellule dendritiche (DC); determina una riduzione delle cellule NK.
JAK2 è associata ai recettori per eritropoietina e trombopoietina. Le mutazioni che attivano costitutivamente JAK2 sono la principale determinante patogenetica di numerose neoplasie mieloproliferative e vengono riscontrate nella grande maggioranza dei pazienti con policitemia vera (PV) e nella metà dei pazienti con mielofibrosi (MF) e trombocitemia essenziale. Mutazioni di JAK sono state identificate in diverse altre neoplasie ematologiche (AML) e sindromi mielodisplastiche (MDS). Gli inibitori di JAK-STAT appartengono alla classe delle small-molecules enzyme inhibitors.
Pratica clinica
Attualmente, in Europa, sono disponibili nella pratica clinica: ruxolitinib, inibitore di JAK1 e JAK2 approvato per il trattamento in seconda linea dei pazienti con MF o PV; tofacitinib, inibitore di JAK1, JAK2, JAK3 e in misura minore di TyK2, approvato per il trattamento dei pazienti con artrite reumatoide (AR) resistente ai DMARD (disease modifying antirheumatic drugs) convenzionali; baricitinib, inibitore di JAK1 e JAK2 che a breve riceverà le stesse indicazioni di tofacitinib. Gli inibitori di JAKSTAT vedono un impiego, per ora sperimentale, anche per il trattamento di forme refrattarie di psoriasi, per alcune forme di AML e per la prevenzione del rigetto nel trapianto di rene (2).
Ruxolitinib
Come accade per molti altri farmaci biologici anche l’uso di inibitori di JAK-STAT è potenzialmente gravato da complicanze infettive. Gli studi registrativi per l’utilizzo di ruxolitinib nella MF hanno un follow-up di oltre 5 anni (studi COMFORT I e II: rispettivamente ruxolitinib versus placebo e versus la migliore opzione terapeutica).
Nel lungo periodo di osservazione l’incidenza di eventi avversi gravi non ematologici ha mostrato una tendenza alla riduzione nei pazienti randomizzati a ruxolitinib, verosimilmente in relazione alla stabilizzazione della malattia ematologica. Le infezioni gravi osservate con maggiore frequenza nei 2 RCT sono state le polmoniti e le sepsi (Tabella 1).
.jpg)
La differenza tra ruxolitinib e il gruppo di controllo non è risultata significativa, ma nel braccio ruxolitinib sono stati più frequenti gli episodi fatali.
.jpg) Diversamente gli episodi di zoster sono risultati significativamente più numerosi nei pazienti randomizzati a ruxolitinib, ma nella quasi totalità dei casi si è trattato di eventi lievi, non recidivanti e mono-dermatomerici (3). I dati di safety relativi ai pazienti in terapia con ruxolitinib per PV sono sostanzialmente sovrapponibili a quelli dei pazienti con MF (2). Uno studio recente documenta l’entità del rischio di riattivazione dell’infezione da HBV in corso di terapia con ruxolitinib, in rari casi anche con antiHBs al baseline (Figura 2) (4).
Diversamente gli episodi di zoster sono risultati significativamente più numerosi nei pazienti randomizzati a ruxolitinib, ma nella quasi totalità dei casi si è trattato di eventi lievi, non recidivanti e mono-dermatomerici (3). I dati di safety relativi ai pazienti in terapia con ruxolitinib per PV sono sostanzialmente sovrapponibili a quelli dei pazienti con MF (2). Uno studio recente documenta l’entità del rischio di riattivazione dell’infezione da HBV in corso di terapia con ruxolitinib, in rari casi anche con antiHBs al baseline (Figura 2) (4).
E’ stata pubblicata molto recentemente anche una revisione di letteratura dei 32 casi descritti di infezione opportunistica grave/fatale in corso di terapia con ruxolitinib. Sono tutti casi isolati, rari, ma richiamano l’attenzione sull’importanza: 1) della conoscenza delle condizioni epidemiologiche locali per patologie come tubercolosi e penicilliosi; 2) dello screening e della diagnosi precoce delle malattie da virus erpetici (segnalati sporadici casi gravi sostenuti da HSV, VZV, CMV, EBV); 3) del rischio di criptoccosi, pneumocistosi e PML anche in presenza di normali conte di linfociti CD4 (5).
Tofacitinib
I dati di safety più completi sull’uso di tofacitinib nei pazienti con AR vengono dall’analisi integrata di 19 studi controllati con un’esposizione cumulativa di circa 20.000 anni-persona (py), un’esposizione mediana di 3.4 py e un follow-up massimo di 8.5 anni (6). L’incidence rate per 100 py è risultato pari a 2.7 per le infezioni gravi; 3.9 per lo zoster (in oltre il 90% dei casi rappresentato però da manifestazioni mono-dermatomeriche e non recidivanti); 0.3 per le infezioni opportunistiche; 0.2 per la tubercolosi. Complessivamente, per quanto difficili siano questi confronti, l’IR delle infezioni gravi con tofacitinib è risultato sostanzialmente sovrapponibile a quello osservato negli RCT con gli altri biologici utilizzati nell’AR (3.0-5.5/100 py) e con gli inibitori di TNF alfa (3.2-4.6/100 py). Confermato il ruolo dei classici cofattori di rischio per infezione grave (uso di steroide, grado di attività della patologia di base, età, leucopenia) (Figura 3).
.jpg)
.jpg) Difficile invece, per la presenza di troppi fattori confondenti, stabilire una correlazione tra posologie più elevate di tofacitinib e maggiore rischio di infezione. L’incidenza di infezioni gravi e opportunistiche appare sostanzialmente stabile nel tempo. Questa si configura forse come una peculiarità di tofacitinib rispetto agli altri biologici, per i quali la quasi totalità dei lavori in letteratura descrive un rischio maggiore nei primi 6- 12 mesi di trattamento (Figura 4).
Difficile invece, per la presenza di troppi fattori confondenti, stabilire una correlazione tra posologie più elevate di tofacitinib e maggiore rischio di infezione. L’incidenza di infezioni gravi e opportunistiche appare sostanzialmente stabile nel tempo. Questa si configura forse come una peculiarità di tofacitinib rispetto agli altri biologici, per i quali la quasi totalità dei lavori in letteratura descrive un rischio maggiore nei primi 6- 12 mesi di trattamento (Figura 4).
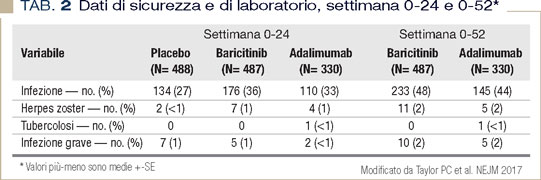 Negli RCT, nessuno dei pazienti con una TB latente al baseline e trattati adeguatamente per almeno un mese prima dell’introduzione di tofacitinib, ha sviluppato successivamente la malattia. Baricitinib Per quanto riguarda baricitinib, gli unici dati di safety utilizzabili, rimangono per ora quelli dello studio registrativo a 52 settimane, condotto su 1.307 pazienti con AR non responsiva a methotrexate (MTX) e randomizzati (3:3:2) a proseguire con placebo, baricitinib o adalimumab (un anti-TNF), mantenendo anche MTX. Al termine dello studio l’incidenza di infezioni gravi e zoster è risultata maggiore nei pazienti trattati con baricitinib rispetto al gruppo placebo, ma sovrapponibile al gruppo trattato con anti- TNF, a fronte però di una migliore risposta clinica con baricitinib (7) (Tabella 2).
Negli RCT, nessuno dei pazienti con una TB latente al baseline e trattati adeguatamente per almeno un mese prima dell’introduzione di tofacitinib, ha sviluppato successivamente la malattia. Baricitinib Per quanto riguarda baricitinib, gli unici dati di safety utilizzabili, rimangono per ora quelli dello studio registrativo a 52 settimane, condotto su 1.307 pazienti con AR non responsiva a methotrexate (MTX) e randomizzati (3:3:2) a proseguire con placebo, baricitinib o adalimumab (un anti-TNF), mantenendo anche MTX. Al termine dello studio l’incidenza di infezioni gravi e zoster è risultata maggiore nei pazienti trattati con baricitinib rispetto al gruppo placebo, ma sovrapponibile al gruppo trattato con anti- TNF, a fronte però di una migliore risposta clinica con baricitinib (7) (Tabella 2).
Bibliografia
- Yamaoka K, Saharinen P, Pesu M, et al. The Janus kinases (Jaks). Genome Biol. 2004; 5(12):253.
- Reinwald M, Silva JT, Mueller NJ, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Intracellular signaling pathways: tyrosine kinase and mTOR inhibitors). Clin Microbiol Infect. 2018; 24 Suppl 2:S53-S70.
- Verstovsek S, Mesa RA, Gotlib J, et al. Long-term treatment with ruxolitinib for patients with myelofibrosis: 5-year update from the randomized, double-blind, placebo-controlled, phase 3 COMFORT-I trial. J Hematol Oncol. 2017; 10(1):55.
- Gill H, Leung GMK, Seto WK, Kwong YL. Risk of viral reactivation in patients with occult hepatitis B virus infection during ruxolitinib treatment. Ann Hematol. 2018 Jun 26.
- Dioverti MV, Abu Saleh OM, Tande AJ. Infectious complications in patients on treatment with Ruxolitinib: case report and review of the literature. Infect Dis (Lond). 2018; 50(5):381-387.
- Cohen SB, Tanaka Y, Mariette X, et al. Long-term safety of tofacitinib for the treatment of rheumatoid arthritis up to 8.5 years: integrated analysis of data from the global clinical trials. Ann Rheum Dis. 2017; 76(7):1253-1262.
- Taylor PC, Keystone EC, van der Heijde D, et al. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med. 2017; 376(7):652-66.






