Il virus dell’epatite E (HEV) rappresenta una delle cause più comuni e tuttavia meno diagnosticate di epatite acuta virale nel mondo (1).
L’Organizzazione Mondiale della Sanità (WHO) stima che HEV causi circa 20 milioni di infezioni ogni anno, responsabili di più di 3 milioni di casi acuti e oltre 44.000 decessi nel 2015 (2).
HEV è un piccolo virus icosaedrico di circa 27-34 nm di diametro, quasi-enveloped, appartenente al genere Hepevirus, famiglia Hepeviridae. Il genoma virale è a RNA a singolo filamento, e contiene tre open reading frames (ORFs): ORF1 codifica per proteine non strutturali necessarie per il processamento e la replicazione virale; ORF2 codifica per le proteine strutturali del capside virale; ORF3 è implicata nel rilascio dei virioni dalle cellule infettate. In base all’analisi filogenetica è possibile classificare 8 genotipi virali, anche se solo 4 sono associati ad infezione umana. In particolare, i genotipi 1 e 2 sembrano infettare solo l’uomo, mentre i genotipi 3 e 4 infettano sia l’uomo che altre specie animali (1).
L’infezione da HEV ha una distribuzione globale, ma i 4 principali genotipi che infettano l’uomo hanno distribuzioni geografiche diverse, associate anche a differenze nelle modalità di trasmissione e nell’outcome della malattia.
I genotipi 1 e 2 sono più diffusi nei paesi dove le condizioni igienico sanitarie sono più carenti; vengono trasmessi per via oro-fecale, prevalentemente mediante il consumo di acqua contaminata e sono responsabili di grandi epidemie e dell’alto tasso di mortalità riscontrato in donne in gravidanza.
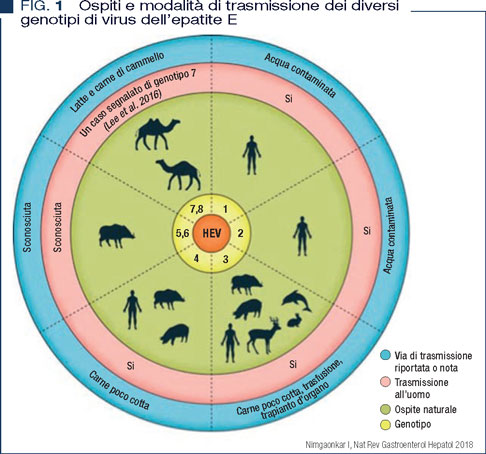 I genotipi 3 e 4 sono invece più diffusi nei paesi industrializzati. Il resevoir principale dell’infezione è il maiale domestico. Infatti, la trasmissione all’uomo avviene principalmente per via zoonotica, mediante il consumo di carne infetta poco cotta, o altri cibi contaminati. Tuttavia è stata dimostrata anche la trasmissione diretta del virus HEV da uomo a uomo, attraverso la trasfusione ed il trapianto d’organo e per via materno fetale (Figura 1).
I genotipi 3 e 4 sono invece più diffusi nei paesi industrializzati. Il resevoir principale dell’infezione è il maiale domestico. Infatti, la trasmissione all’uomo avviene principalmente per via zoonotica, mediante il consumo di carne infetta poco cotta, o altri cibi contaminati. Tuttavia è stata dimostrata anche la trasmissione diretta del virus HEV da uomo a uomo, attraverso la trasfusione ed il trapianto d’organo e per via materno fetale (Figura 1).
I segni e i sintomi clinici di infezione sono sovrapponibili a quelli osservati nelle altre forme di epatite virale acuta, anche se molti individui restano asintomatici. Nella maggior parte dei casi, gli individui che si infettano eliminano spontaneamente il virus senza particolari complicanze, anche se è possibile lo sviluppo di uno scompenso epatico soprattutto nei soggetti con un danno epatico cronico preesistente o quando l’infezione è contratta durante la gravidanza. Sono stati descritti casi di infezione cronica da HEV, pressoché esclusivamente in ospiti immunocompromessi (ad esempio post-trapianto). La diagnosi di infezione acuta si basa sull’identificazione di IgM anti-HEV, anche se occorre ricordare che con tutte le metodiche disponibili non sono infrequenti i casi di falsa positività e negatività. E’ pertanto fondamentale la conferma con ulteriori test sierologici e con la ricerca di sequenze virali specifiche (HEV RNA). La determinazione di IgG è invece utile a identificare l’esposizione pregressa (3).
L’epatite E può essere trasmessa con la trasfusione. Inizialmente, la trasmissione è stata descritta in zone endemiche, dove predomina il genotipo 1. Tuttavia, studi successivi hanno documentato la trasmissione anche in paesi europei (tra cui Francia, Regno Unito e Germania), dove il genotipo 3 è quello maggiormente rappresentato. Diversi emocomponenti, tra cui concentrati eritrocitari, piastrinici e granulocitari, oltre al plasma fresco congelato, sono stati implicati nella trasmissione (3-5).
Gli studi condotti sulle donazioni di sangue e sulla popolazione generale hanno evidenziato una ampia variabilità di prevalenza di reattività anticorpale IgG anti-HEV e di viremia. Le aree a più alta sieroprevalenza sono naturalmente in paesi dove l’infezione è endemica, come Nepal (47%) e Bangladesh (50%). Tuttavia, anche paesi europei come Francia (25-53%) e Olanda (21-27%) presentano prevalenze piuttosto alte. I paesi dove l’infezione da HEV sembra essere meno diffusa sono: Nuova Zelanda, Australia, Canada, e Scozia (tutte tra il 4% e il 6%). In linea generale, la prevalenza di viremia tra i donatori di sangue nei diversi paesi varia armonicamente con la sieroprevalenza anticorpale, attestandosi su valori che vanno da 1:762 in Olanda a 1:9500 negli Stati Uniti (4).
Per quanto riguarda gli studi di trasmissione trasfusionale, il più ampio è stato condotto da Hewitt e coll. nel Regno Unito (5). I ricercatori hanno esaminato 225.000 donazioni, 79 delle quali sono risultate positive per HEV RNA di genotipo 3 in PCR (1 su 2.850). Le donazioni sono state usate per preparare 129 emocomponenti, 62 dei quali sono stati trasfusi.
Gli autori hanno in seguito calcolato che la dose minima in grado di trasmettere l’infezione era di 2x10^4 UI di HEV RNA, e che il 55% degli emocomponenti con almeno questa dose aveva trasmesso l’infezione ai riceventi.
I dati circa il rischio trasfusionale nel nostro paese sono piuttosto scarsi, anche se alcuni studi - tra cui uno promosso dal Centro Nazionale Sangue - sono in corso. Un’iniziale valutazione effettuata nel 2016 su un piccolo campione di donatori abruzzesi aveva sollevato un certo allarme, dal momento che erano state osservate due donazioni viremiche su un totale di 313 esaminate, con una prevalenza di IgG anti-HEV del 49% (6). Tuttavia, studi più recenti eseguiti dal nostro gruppo su 10.000 donatori residenti in Nord Italia (7), indicano prevalenze di viremia e di reattività anticorpale ben più contenute ed assimilabili ai paesi occidentali a più bassa endemia (HEV RNA 1 su 10.000, IgG anti HEV 9.7%).
Complessivamente, la comunità scientifica sta dedicando grande interesse al problema. Inoltre, diversi paesi hanno già introdotto diversi approcci di screening NAT (universale o parziale) sui donatori. Tra questi, Regno Unito, Irlanda, Francia, Olanda e Giappone. In altri paesi, tra cui l’Italia, si attendono dati a supporto di una eventuale decisione (3).
Lo screening NAT comporta infatti costi considerevoli, anche se, soprattutto in quei paesi dove la circolazione di HEV è maggiore, il rapporto costoefficacia sarebbe in linea con quello dello screening HIV, HBV e HCV. Non ci si attende però che l’introduzione di uno screening sulle donazioni abbia un impatto importante nel limitare nuovi casi di infezione. In Inghilterra, per esempio, è stato calcolato che i casi di infezione da HEV acquisita per via trasfusionale siano una piccolissima frazione di quelli complessivi (inferiore all’1%); in altri termini, il rischio di acquisire l’infezione per via zoonotica in un anno per un soggetto sano con alimentazione normale equivale a quello di un paziente che riceve 13 unità di emocomponenti da donatori diversi (3, 4). Anche su questa base l’EASL ha recentemente raccomandato di introdurre lo screening NAT solo quando sia evidente un bilancio favorevole tra il rischio di trasmissione e le stime di costo ed efficacia, parametri molto variabili a seconda dell’area geografica e delle risorse disponibili (4).
Nonostante gli elevatissimi livelli di sicurezza raggiunti dai sistemi trasfusionali occidentali, esiste ancora la possibilità di trasmettere malattie infettive da donatore a ricevente.
Nel decidere le politiche di screening, le istituzioni nazionali devono preoccuparsi, oltre che di tutelare la salute dei singoli riceventi, di contrastare l’emersione o l’amplificazione di epidemie.
Come sintetizzato da Bloch e coll. in un recente editoriale (8), le misure di screening trasfusionale una volta introdotte, sono molto difficili da revocare. Anche per questo, è necessario uno studio italiano di buona qualità scientifica sul rischio trasfusionale di trasmettere HEV, che guidi una decisione equilibrata e basata su evidenze scientifiche.
Bibliografia
- Nimgaonkar I, Ding Q, Schwartz RE, et al. Hepatitis E virus: advances and challenges. Nat Rev Gastroenterol Hepatol 2018; 15:96-110.
- WHO Hepatitis E - Key facts (2016). World Health Organization Fact Sheet. URL: http://www.who.int/mediacentre/factsheets/ fs280/en/ Accesso 28/06/18.
- European Association for the Study of the Liver. Clinical Practice Guidelines on hepatitis E virus infection. J Hepatol 2018; 68:1256-1271.
- Ankcorn MJ, Tedder RS. Hepatitis E: the current state of play. Transfus Med 2017; 27:84-95.
- Hewitt PE, Ijaz S, Brailsford, et al. Hepatitis E virus in blood components: a prevalence and transmission study in southeast England. Lancet 2014; 384:1766-1773.
- Lucarelli C, Spada E, Taliani G, et al. High prevalence of anti-hepatitis E virus antibodies among blood donors in central Italy, February to March 2014. Euro Surveill 2016; 21(30).
- Spreafico M, Raffaele L, Guarnori I, et al. Prevalence and 9 years incidence of HEV infection in regular blood donors in Lombardy: an estimate of transfusion risk. Blood Transfus 2018; 16 Suppl. 1; s184.
- Bloch EM, Ness PM, Tobian AAR, et al. Revisiting blood safety practices given emerging data about Zika virus. N Engl J Med 2018; 378:1837-1841.






