Lo studio delle complicanze neurologiche associate alla terapia antiretrovirale (ART) nei pazienti con infezione da HIV nasce alla fine degli anni 90 e fa seguito all’introduzione di una terapia antiretrovirale pienamente attiva (HAART). Tale innovazione riflette il passaggio da una terapia inefficace ad una finalmente in grado di bloccare la replica virale, trasformando, di fatto, una malattia letale in una patologia cronica terapeuticamente gestibile. Naturalmente quello che non aveva modo di palesarsi in una patologia a prognosi infausta, compare quando lo scenario cambia e i pazienti possono convivere con la malattia e con una terapia quotidiana, che, per dare un risultato duraturo, deve però risultare efficace e ben tollerata a lungo termine.
Lo sviluppo di regimi antiretrovirali che fossero ben tollerati e garantissero buona qualità di vita è stata una conquista graduale. Le terapie iniziali potevano dare problemi, come accadeva per esempio con efavirenz, un NNRTI di grande efficacia, ma che in alcuni casi procurava intolleranza neurologica con comparsa di incubi notturni e insonnia, fino a casi più rari di induzione al suicidio (1). Tale problematica non sembrò evidenziarsi con altri farmaci per cui all’occorrenza si poteva passare ad altro regime, ma nonostante ciò, efavirenz è rimasto a lungo il gold standard del trattamento antiretrovirale per efficacia e facilità di assunzione in termini posologici.
Esisteva quindi il problema di bilanciare la tollerabilità con l’efficacia e considerare non solo l’effetto sulla replica plasmatica, ma la capacità di agire sul virus latente nei reservoir. Di fatto, da un lato, si voleva ridurre la tossicità neurologica potenziale dei farmaci, dall’altro si cercava di utilizzare regimi che avessero miglior penetrazione nel Sistema Nervoso Centrale (SNC) per evitare che in tale sede il virus fosse libero di indurre danni neurologici se i farmaci non fossero stati attivi in concentrazione adeguata. Bisognava evitare che si sviluppasse una “dissociazione emato-liquorale”, in cui la virosoppressione plasmatica avrebbe nascosto una progressione del danno subclinico neuronale. Dati anatomo-radiologici postmortem, infatti, mostravano che le RMN di pazienti deceduti con infezione da HIV, asintomatici sul piano neurologico, presentavano segni di atrofia cerebrale maggiori rispetto ai controlli sieronegativi per HIV e minori rispetto ai pazienti deceduti per AIDS con malattia più avanzata. Questo faceva pensare che il danno neuronale avvenisse in una fase precoce di malattia e fosse per lo più misconosciuto essendo riscontrato anche nei pazienti asintomatici (2).
Si fecero pertanto diversi studi anche sulla diffusione degli antiretrovirali nel SNC e nella pratica clinica si cominciò a fare ricorso ad uno score che prevedeva la capacità di penetrazione del regime attraverso la barriera emato-liquorale (CPE score) (3). Studi successivi tuttavia fecero nascere dubbi sulla reale possibilità che il CPE score fosse associato ad un miglior outcome neurocognitivo nel paziente con infezione da HIV (4).
La ricerca si è quindi concentrata sulla necessità di capire come valutare, definire ed in qualche modo misurare il danno neurologico, che spesso era per lo più subclinico e pertanto sottostimato. Vennero così pubblicati i criteri di Frascati che miravano a fare ordine e ad uniformare le modalità diagnostiche e gli aspetti clinici relativi alla sofferenza neurologica del paziente con infezione da HIV (5). Sono stati coniati diversi acronimi per descrivere il quadro clinico del paziente. Quando compaiono sintomi neurologici si parla di HAND (disturbo neurocognitivo associato ad HIV), che fa riferimento ad una serie di disturbi, dalle amnesie, alle difficoltà deambulatorie con quadri di atrofia cerebrale e/o danno neuronale. La HAND include poi l’ANI, che indica un danno neurocognitivo asintomatico, la MND, che evidenzia modesto disordine neurocognitivo, mentre la HAD è relativa ad un quadro di demenza associata all’infezione (5). Tutte queste forme venivano diagnosticate con l’ausilio di test neurocognitivi standardizzati che potevano in tal modo consentire di valutare l’entità del danno neuronale e la sua prevalenza nelle diverse coorti di pazienti con infezione da HIV. Si scoprì così che in epoca pre-HAART era più elevata la prevalenza di quadri di HAD, verosimilmente dovuti al danno virale.
Con l’avvento della HAART ed il conseguente miglior controllo della replica virale, la HAD si era fortemente ridotta dal 20 al 50%, mentre al contrario era aumentata la prevalenza delle forme più lievi, ANI e MND, probabilmente indotte dagli antiretrovirali adottati (6).
Per lungo tempo il successo terapeutico ed il miglioramento prognostico assicurato dalla terapia hanno fatto passare in secondo piano alcuni aspetti di tollerabilità a lungo termine, in particolare quella neurologica, soprattutto per la preponderanza dei quadri subclinici e per la mancanza di iniziale standardizzazione diagnostica. Coi criteri di Frascati si è avuta la possibilità di analizzare i pazienti in terapia antiretrovirale con disturbi neurologici subclinici, per cui l’attenzione della ricerca si è concentrata sulla comprensione dei meccanismi di eventuale danno neurotossico farmaco-indotto.
D’altro canto, si era già visto in passato che i pazienti con maggior evidenza di disturbi neurologici erano quelli che avevano regimi con maggior penetrazione neuronale e che i disturbi di tipo neurocognitivo si riducevano alla sospensione della ART (7). Naturalmente sono maggiori i benefici della terapia che gli effetti collaterali, ma lo studio del danno neurologico da farmaci resta importante per impostare regimi meno impattanti sul SNC e produrre per il futuro molecole senza effetti collaterali di tipo neurocognitivo.
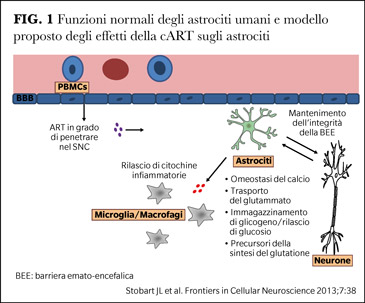 Il problema è ancora di grande attualità, ad esempio un lavoro recente di Gonzalez et al. mostra il tipo di danno neuronale associato alla terapia antiretrovirale (8). Gli autori focalizzano lo studio sugli astrociti, cellule del SNC importanti per il mantenimento dell’omeostasi e dell’integrità della barriera emato-encefalica (BEE). Agiscono mantenendo l’omeostasi del glutatione che a sua volta riduce lo stato ossidativo. I farmaci che superano la BEE possono danneggiare gli astrociti, ridurre il riassorbimento di glutammato e rilasciare citochine infiammatorie col risultato finale di un danno ossidativo agli stessi astrociti e ai neuroni (Figura 1).
Il problema è ancora di grande attualità, ad esempio un lavoro recente di Gonzalez et al. mostra il tipo di danno neuronale associato alla terapia antiretrovirale (8). Gli autori focalizzano lo studio sugli astrociti, cellule del SNC importanti per il mantenimento dell’omeostasi e dell’integrità della barriera emato-encefalica (BEE). Agiscono mantenendo l’omeostasi del glutatione che a sua volta riduce lo stato ossidativo. I farmaci che superano la BEE possono danneggiare gli astrociti, ridurre il riassorbimento di glutammato e rilasciare citochine infiammatorie col risultato finale di un danno ossidativo agli stessi astrociti e ai neuroni (Figura 1).
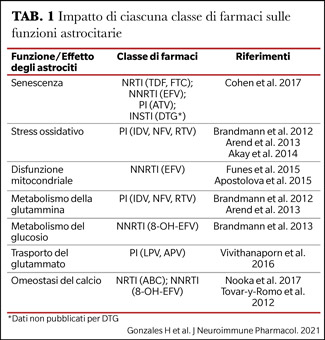 Gli astrociti, danneggiati dai farmaci antiretrovirali, possono diventare senescenti (astrogliosi), con conseguente loro disfunzione e sofferenza neuronale. I meccanismi del danno possono essere diversi in base al tipo di farmaco coinvolto e questo deve far riflettere sul ruolo potenziale della ART e sul suo impatto sugli astrociti nella patogenesi della HAND (Tabella 1).
Gli astrociti, danneggiati dai farmaci antiretrovirali, possono diventare senescenti (astrogliosi), con conseguente loro disfunzione e sofferenza neuronale. I meccanismi del danno possono essere diversi in base al tipo di farmaco coinvolto e questo deve far riflettere sul ruolo potenziale della ART e sul suo impatto sugli astrociti nella patogenesi della HAND (Tabella 1).
In passato sono stati molteplici i farmaci potenzialmente in grado di indurre neurotossicità a prescindere dalle classi di appartenenza, ma vanno fatte però delle considerazioni sulla safety degli antiretrovirali attualmente in uso.
In tal senso darunavir/cobicistat (DRV/c), a differenza dei PI di prima generazione, ha mostrato un ottimo profilo di sicurezza sul SNC dai dati di letteratura, come si evince sia dallo studio AMBER in cui era utilizzato nei pazienti naive, sia nello studio EMERALD che arruolava pazienti in switch (9-10). Questo senza pregiudicarne l’efficacia, in considerazione dell’ottima concentrazione di DRV/c nel SNC, dove la sua forma libera nel liquor supera l’IC90 per l’HIV (11). Questo lo rende un farmaco ideale per il controllo della replica virale in questo tipo di reservoir.
Anche doravirina, un nuovo NNRTI, sembra mostrare una safety neurologica migliore rispetto ad efavirenz (12).
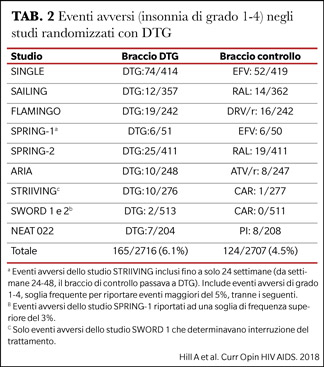 Riguardo agli inibitori di integrasi, invece, sembrano emergere alcuni problemi di tollerabilità neurologica. Una metanalisi di A. Hill et al. ha valutato la tollerabilità di dolutegravir (DTG) in termini cardiaci e neurologici (13). Gli autori non hanno riscontrato una significativa tossicità cardiaca, mentre relativamente all’impatto neurologico, è apparsa chiara la correlazione di DTG con l’insonnia (Tabella 2).
Riguardo agli inibitori di integrasi, invece, sembrano emergere alcuni problemi di tollerabilità neurologica. Una metanalisi di A. Hill et al. ha valutato la tollerabilità di dolutegravir (DTG) in termini cardiaci e neurologici (13). Gli autori non hanno riscontrato una significativa tossicità cardiaca, mentre relativamente all’impatto neurologico, è apparsa chiara la correlazione di DTG con l’insonnia (Tabella 2).
Un recente studio di real life su un’ampia coorte multicentrica europea, ha valutato 9702 pazienti trattati con INSTI, paragonando quelli che ricevevano DTG con quelli in terapia con raltegravir (RAL) ed elvitegravir (EVG) (14). I pazienti in DGT hanno presentato il più elevato tasso di sospensione a 6 mesi dall’inizio della terapia (44.2% DTG, 42.5% EVG, 17.3% RAL). La causa principale di sospensione del regime è stata la tossicità neurologica ed anche in tal caso ha interessato prevalentemente DTG (31.8% DTG, 23.4% EVG, 6.6% RAL).
L’analisi dell’impatto dei disturbi neurocognitivi legati alla ART a lungo termine è sicuramente interessante e serviranno altri studi per avere un quadro più chiaro. Questo sarà importante anche nell’ottica di nuovi regimi che avremo a disposizione, con nuove posologie che garantiranno una nuova farmacocinetica (long acting), ma analogamente dovranno assicurare una buona tollerabilità.
- Decloedt EH, Maartens G. Neuronal toxicity of efavirenz: a systematic review. Expert Opin Drug Saf. 2013;12(6):841-6.
- Hassine D, Gray F, Chekroun R et al. [Early cerebral lesions in HIV infection. Postmortem radio-pathologic correlations in non-AIDS asymptomatic seropositive patients]. J Neuroradiol. 1995;22(3):148-60.
- Letendre S, Marquie-Beck J, Capparelli E et al. Validation of the CNS Penetration-Effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Arch Neurol. 2008;65(1):65-70.
- Arentoft A, Troxell K, Alvarez K et al. HIV Antiretroviral Medication Neuropenetrance and Neurocognitive Outcomes in HIV+ Adults: A Review of the Literature Examining the Central Nervous System Penetration Effectiveness Score. Viruses. 2022;14(6):1151.
- Antinori A, Arendt G, Becker JT et al. Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-99.
- Heaton RK, Franklin DR Jr, Deutsch R, Letendre S et al. CHARTER Group. Neurocognitive change in the era of HIV combination antiretroviral therapy: the longitudinal CHARTER study. Clin Infect Dis. 2015;60(3):473-80.
- Robertson KR, Su Z, Margolis DM et al. Neurocognitive effects of treatment interruption in stable HIV-positive patients in an observational cohort. Neurology. 2010 ;74(16):1260-6.
- Gonzalez H, Podany A, Al-Harthi L et al. The far-reaching HAND of cART: cART effects on astrocytes. J Neuroimmune Pharmacol. 2021;16(1):144-158.
- Eron JJ, Orkin C, Gallant J et al. AMBER study group. A week-48 randomized phase-3 trial of darunavir/cobicistat/emtricitabine/tenofovir alafenamide in treatment-naive HIV-1 patients. AIDS. 2018 ;32(11):1431-1442.
- Orkin C, Molina JM, Negredo E et al. EMERALD study group. Efficacy and safety of switching from boosted protease inhibitors plus emtricitabine and tenofovir disoproxil fumarate regimens to single-tablet darunavir, cobicistat, emtricitabine, and tenofovir alafenamide at 48 weeks in adults with virologically suppressed HIV-1 (EMERALD): a phase 3, randomised, non-inferiority trial. Lancet HIV. 2018;5(1):e23-e34.
- Croteau D, Rossi SS, Best BM et al. CHARTER Group. Darunavir is predominantly unbound to protein in cerebrospinal fluid and concentrations exceed the wild-type HIV-1 median 90% inhibitory concentration. J Antimicrob Chemother. 2013;68(3):684-9.
- Gatell JM, Morales-Ramirez JO, Hagins DP et al. Doravirine dose selection and 96-week safety and efficacy versus efavirenz in antiretroviral therapy-naive adults with HIV-1 infection in a Phase IIb trial. Antivir Ther. 2019;24(6):425-435.
- Hill AM, Mitchell N, Hughes S, Pozniak AL. Risks of cardiovascular or central nervous system adverse events and immune reconstitution inflammatory syndrome, for dolutegravir versus other antiretrovirals: meta-analysis of randomized trials. Curr Opin HIV AIDS. 2018;13(2):102-111.
- Greenberg L, Ryom L, Wandeler G et al.; RESPOND Study Group. Uptake and Discontinuation of Integrase Inhibitors (INSTIs) in a Large Cohort Setting. J Acquir Immune Defic Syndr. 2020;83(3):240-250.






