A differenza delle meningiti acquisite in comunità, le meningiti e ventricoliti infettive conseguenti a procedure neurochirurgiche sono da considerarsi correlate all’assistenza. Queste infezioni sono prevalentemente associate a dispositivi posizionati, nella loro componente prossimale, nel sistema nervoso centrale (SNC) quali: derivazioni (shunts) liquorali (ventricolo-peritoneali [DVPe], ventricolo-pleuriche [DVPl], ventricolo-atriali [DVAt]), drenaggi liquorali esterni (ventricolari [DVE] o lombari [DLE]), stimolatori cerebrali profondi (DBS, deep brain stimulators), pompe di infusione intratecale.
La frequenza delle meningiti e ventricoliti postneurochirurgiche varia dal 5-15% nelle forme associate a shunts, a 0-22% per i DVE, 5% per i DLE, 0.6-14.3% nel caso dei DBS, 3.6% nelle pompe infusionali sottofasciali e 20% per quelle sottocutanee (1).
Le principali modalità di infezione, che si verificano con frequenza relativa diversa in base al device coinvolto, sono le seguenti (1):
- acquisizione intraoperatoria, che prevale negli shunts (sino al 74% dei casi).
- via retrograda, a partire da infezione dell’estremità distale del dispositivo, che prevale nei drenaggi esterni, specie a seguito di manipolazioni quali prelievi di liquido cefalo-rachidiano (LCR), ma è possibile anche negli shunts (es. a seguito di peritonite nelle DVPe o di pleurite nelle DVPl).
- contaminazione cutanea, che può interessare tutti i device, con diversi meccanismi possibili, quali: negli shunts, puntura del reservoir impiantato sottocute per prelievi di LCR o iniezione di farmaci; erosione cutanea da parte del catetere (o dell’estensione dello stimolatore di DBS) sino alla sua esposizione; nel postoperatorio.
- via ematogena, prevalente nelle DVAt a partire dall’estremità distale (atriale), seguita da estensione dell’infezione per via retrograda.
L’eziologia delle meningiti e ventricoliti postneurochirurgiche è rappresentata prevalentemente da batteri Gram-positivi colonizzanti la cute, in particolare stafilococchi coagulasi-negativi, C.acnes, S.aureus e difteroidi, e raramente da bacilli Gram-negativi (inclusa P. aeruginosa), anaerobi e Candida spp (1). Più frequentemente, le infezioni si manifestano entro le prime 3-4 settimane dopo la procedura neurochirurgica e in tal caso sono spesso sostenute da patogeni ospedalieri multifarmacoresistenti (MDR) (1). Questa review sintetizza i concetti chiave per un corretto approccio terapeutico di tali patologie, rimandando a fonti più estese (1) la trattazione di altri aspetti come la diagnosi e la prevenzione. La grande complessità di queste infezioni rende indispensabile per la loro corretta gestione una stretta collaborazione tra neurochirurgo, infettivologo, microbiologo e farmacologo clinico.
Rimozione del dispositivo infetto
Nelle infezioni associate a device, questo dovrebbe essere completamente rimosso ogni qualvolta sia possibile. Infatti, in caso contrario, le probabilità di fallimento e recidive a seguito della sola terapia antimicrobica sono molto più elevate in ragione della scarsa attività dei farmaci nei confronti del biofilm che invariabilmente si forma sul device (1). Nel caso di shunt, ove non sia possibile un periodo “libero” da qualsiasi dispositivo dopo la sua rimozione, è necessario il posizionamento di un drenaggio esterno sino alla sterilizzazione del LCR e l’impianto di un nuovo shunt (1,4). In una recente coorte di 86 episodi di infezione di DVP, all’analisi multivariata, l’unico fattore associato al fallimento terapeutico era la ritenzione dello shunt, con un OR pari a 46 (95% CI 5.3-399.8); inoltre, i fallimenti erano molto più frequenti nella sostituzione dello shunt infetto nella stessa seduta operatoria, rispetto alla sostituzione in due tempi (68 vs. 11%; OR 17.88, 95% CI 4.3-73.8) (2).
Il reimpianto del dispositivo può avvenire 7-10 gg dopo la negatività delle colture del LCR (1).
Per infezioni circoscritte di DBS, può intentarsi una rimozione parziale del device (stimolatore ed estensioni) con ritenzione degli elettrodi e loro protezione mediante cateteri antibiotati, seguita, in caso di fallimento, da rimozione dell’intero hardware (3).
Terapia antimicrobica
Mancano adeguati trials randomizzati che definiscano il trattamento ottimale delle meningiti e ventricoliti postneurochirurgiche.
Per le notevoli difficoltà di cura di tali infezioni ed il rischio elevato di batteri MDR, è imperativo, prima della somministrazione di antimicrobici, ogni sforzo possibile volto all’identificazione del patogeno responsabile e della sua sensibilità ai farmaci, al fine di consentire una scelta mirata degli antimicrobici.
Approccio empirico
Qualora, nelle more dell’ottenimento dell’esito delle indagini microbiologiche, sia necessario avviare una terapia empirica, questa deve basarsi sulle eziologie più probabili sopra citate, sull’epidemiologia microbica locale (specie e profili di sensibilità più frequenti) e su eventuali patogeni precedentemente isolati dal CSF o da altri siti di infezione/ colonizzazione nello stesso paziente (1). In generale è raccomandata un’associazione di vancomicina più un betalattamico anti-pseudomonas (es. cefepime, ceftazidime o meropenem); nei pazienti con storia di grave allergia a betalattamici e in cui meropenem sia controindicato, e possibile sostituire gli stessi con aztreonam o ciprofloxacina (1).
Approccio mirato
La Tabella 1 illustra gli antimicrobici raccomandati in base al patogeno isolato e la loro sensibilità ai farmaci. Tuttavia, la scelta dei farmaci, della modalità di somministrazione e della posologia deve anche tener conto delle peculiarità farmacocinetiche/farmacodinamiche (PK/PD) degli antimicrobici nei vari comparti del SNC.
.jpg)
Aspetti di PK/PD degli antimicrobici nel SNC
Studi clinici adeguati che definiscano i target ottimali PK/PD degli antimicrobici nel LCR sono carenti. Pertanto, tali target sono prevalentemente estrapolati da studi relativi a infezioni gravi non del SNC, come nella sepsi o polmonite grave.
Idealmente, ai fini di una eradicazione dell’infezione, l’antimicrobico dovrebbe conseguire un quoziente inibitorio nel LCR (ratio concentrazione farmaco/ MIC del patogeno) di almeno 10 (1). Tuttavia, svariati fattori ostacolano l’ottenimento di questo target, per cui, secondo diversi autori, nella real-life lo stesso parametro potrebbe considerarsi adeguato anche se ≥2-4 (4).
Oltre alla nota restrizione della diffusione dei farmaci attraverso le barriere emato-liquorale (BEL) ed ematoencefalica (BEE), vanno considerati i seguenti fattori limitanti e di variabilità inter/intra-individuale dell’attività degli antimicrobici nei diversi distretti del SNC:
- a seguito di infezione e flogosi, l’entità dell’alterazione delle barriere (BEE, BEL), e conseguentemente della diffusione di farmaci, è variabile tra soggetti diversi e - nello stesso soggetto - in rapporto all’evoluzione dell’infezione (1,4)
- il SNC non va considerato come un compartimento omogeneo. Ad esempio, il grado di flogosi a livello ventricolare, e conseguentemente la permeabilità e diffusione degli antibiotici, sono minori rispetto alle meningi (4).
- il drenaggio quotidiano di LCR tramite shunt e derivazioni esterne è variabile, influenzando così una variabilità inter/intra-soggetto della clearance e delle concentrazioni finali dei farmaci (5)
- l’attività degli antimicrobici nel LCR può essere limitata rispetto al siero, oltre che dalle concentrazioni più basse raggiunte, anche dal pH inferiore e dalla frequentemente minore attività replicativa dei germi (4).
- diverse caratteristiche condizionano la diffusione degli antimicrobici dal sangue nel LCR, ma principalmente: lipofilia, massa molecolare, legame con le proteine plasmatiche, interazioni con i sistemi di trasporto (4,6). Le molecole che diffondono meglio, specie a barriere non o poco alterate, sono quelle più piccole, lipofile, e con basso legame proteico.
Ad esempio linezolid - che presenta MM 337 Da, coefficiente di ripartizione (partition coefficient, PC) 2.7, legame proteico (LP) 31% - raggiunge dopo infusione ev della dose standard ev di 600 mg/12h una concentrazione nel LCR pressoché sovrapponibile a quella del siero: AUCLCR/AUCS = 1.0±0.3 già dopo la prima dose, e = 0.8±0.3 allo steady state (SS) (7).
Fosfomicina ev, benchè idrofila (PC 0.001), grazie alle sue piccole dimensioni (MM 138 Da) e ad un basso legame proteico (<10%), raggiunge allo SS una diffusione liquorale soddisfacente (AUCLCR/AUCS =0.27) ed efficace se usata in dose piena (24 g/die, suddivisi in 3-4 somministrazioni), contro patogeni con MIC basse (≤ 8-16 mg/L) ed in combinazione con altri antimicrobici attivi (8).
In caso di molecole idrofile e/o di dimensioni maggiori, è difficile stimare l’attuale grado di flogosi della BEL e quindi di potenziale diffusione degli antibiotici nel SNC. Ad esempio la diffusione di meropenem (MM 383 Da, LP 2%) e vancomicina (MM 1.449 Da, PC <0.01, LP 55%), dopo infusione ev, è nel complesso bassa e mostra un’alta variabilità interindividuale. Ne consegue il rischio di una quota significativa di pazienti in cui la concentrazione liquorale dei farmaci, a seguito di dosi ev standard, rimane al di sotto della MIC del patogeno (Figura 1).
.jpg)
Le possibili principali strategie per gestire le problematiche di cui sopra e ottimizzare l’efficacia terapeutica, specie nei confronti di patogeni farmacoresistenti, sono le seguenti (1):
- preferire farmaci ad attività battericida.
Nella terapia sistemica:
- scegliere molecole con adeguata diffusione e concentrazione nel SNC, sulla base delle caratteristiche sopra illustrate
- aumentare la dose, ove possibile. Questo è consentito specie dai betalattamici, la cui efficacia può essere ottimizzata anche mediante una loro infusione prolungata (durata ≥50% dell’intervallo tra le dosi). Ad esempio, sono stati utilizzati con buona tollerabilità, cefotaxime sino a 300 mg/Kg/die (4) e meropenem sino a 15 g/die (9).
Anche vancomicina può essere somministrata ev sino alla dose di 60 mg/Kg/die (in 3 somministrazioni o infusione continua) (10); tuttavia, per limitarne la tossicità renale, è opportuno non superare per le dosi frazionate una Cmin di 20 mg/L e, per l’infusione continua, una Css di 25 mg/L (misurate allo SS, dopo 3-4 gg di terapia). - ricorrere ad un monitoraggio terapeutico dei farmaci (TDM) nel LCR, con conseguente adeguamento della posologia.
Terapia antimicrobica intraventricolare e intratecale
Qualora, nonostante le possibili strategie di ottimizzazione terapeutica, il target PK/PD anzidetto non sia conseguibile con la sola terapia sistemica e/o la risposta terapeutica a quest’ultima non sia adeguata, può essere considerata, specie in presenza di germi MDR o dell’impossibilità di rimuovere il device, una somministrazione intraventricolare o intratecale di antimicrobici selezionati. Tale approccio presenta il vantaggio principale di consentire concentrazioni liquorali elevate dei farmaci non ottenibili con la sola infusione endovenosa. Tra le limitazioni: assenza di trials controllati e randomizzati, dosi e durata della terapia non ben stabilite, impiego generalmente off-label, rischio di tossicità locale, rischio di sovrainfezione dovuta alla manipolazione dei drenaggi per la somministrazione (1). Le raccomandazioni sono basate principalmente su studi PK/PD e su serie di casi clinici.
Una somministrazione intraventricolare di vancomicina di 10 mg ha determinato la persistenza di concentrazioni liquorali elevate (10 mg/L dopo 21 h) con buona tollerabilità (11).
Daptomicina, per le sue elevate dimensioni ed idrofilia (MM 1,621 Da, PC ≈ 0.00001), ed alto legame proteico (92%), presenta una ridottissima diffusione con concentrazioni liquorali inefficaci: dopo una dose ev di 10 mg/Kg in nove pazienti con meningite postneurochirugica si otteneva (medie): Cmax LCR=0.21 mg/L, ratio AUCLCR/AUCS =0.45, e di Cmax LCR/ Cmax S = 0.12 (12). Al contrario, una somministrazione intraventricolare di datptomicina alla dose di 5 mg/die consentiva 16h dopo la terza dose una concentrazione del LCR ventricolare ancora elevata (11 mg/L) e, associata a linezolid ev, una negativizzazione delle colture nella ventricolite da E. faecium resistente a vancomicina già dopo la prima dose (13).
Diversi lavori e reviews hanno dimostrato un’efficacia di colistina intraventricolare o intratecale (125.000- 500.000 UI/24h per una durata prevalente di 14- 21 gg), con soddisfacenti tassi di guarigione anche microbiologica, in meningiti e ventricoliti associate a device da A. baumannii, K. pneumoniae e P. aeruginosa MDR/XDR (5,14,15).
La combinazione di beta-lattamici anti-pseudomonas per via ev con gentamicina intratecale ha determinato una riduzione di recidiva delle ventricoliti rispetto alla terapia ev da sola (1). I farmaci utilizzati e le dosi iniziali consigliate per la terapia intra-ventricolare/tecale sono illustrati nella Tabella 2.
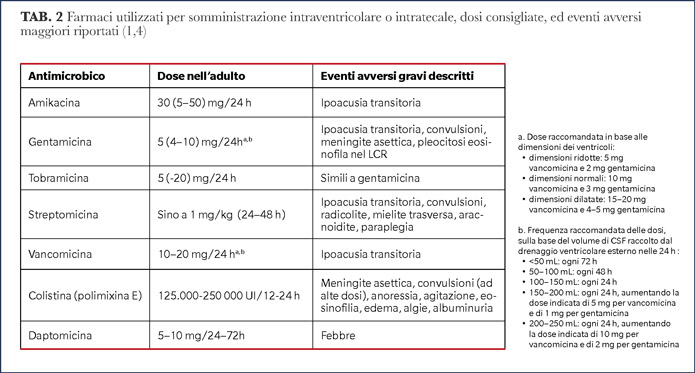
Da notare che le dosi e la loro frequenza, oltre che basate sul target PK/PD, sono anche funzione del volume ventricolare e dell’output giornaliero di LCR dai drenaggi. Le dosi successive alla prima dovrebbero idealmente essere adeguate in base al TDM (Ctrough) sul LCR (possibilmente prelevato dal sito di infezione) ed alla MIC del patogeno isolato.
Aspetti rilevanti nella terapia intra-ventricolare/tecale
- è raccomandata la massima antisepsi nella diluizione dei farmaci (da attuarsi quindi presso la farmacia) e nella loro somministrazione, la quale deve avvenire subito dopo la diluizione (1).
- l’instillazione intra-tecale/ventricolare va effettuata con estrema cautela, considerando i fattori condizionanti la sicurezza, oltre l’efficacia, inclusi volume, osmolarità e pH (6). Utilizzare esclusivamente formulazioni senza additivi per il rischio di tossicità locale indotto da questi (principalmente meningite/ventricolite chimica e convulsioni) (1,6).
- prima della somministrazione del farmaco, drenare lentamente LCR nello stesso volume della soluzione infusa. Subito dopo la dose, iniettare un volume di S.F. pari allo spazio morto del drenaggio e clampare lo stesso per almeno 30-60 m’ (1).
- la somministrazione di un farmaco in uno dei ventricoli laterali può determinare concentrazioni finali nel ventricolo controlaterale significativamente inferiori e spesso insufficienti (13), mentre rimangono valide quelle nei tratti “a valle” del flusso liquorale (III-IV ventricolo e spazi subaracnoidei spinale e craniale).
- la somministrazione intra-tecale/ventricolare di betalattamici è controindicata per la loro tossicità locale, in particolare per il rischio di convulsioni (1,4).
- è sempre consigliato associare alla terapia intraventricolare/ tecale la somministrazione endovenosa dello stesso farmaco (1).
Monitoraggio e durata della terapia
Mancano trial randomizzati che definiscano la durata della terapia antimicrobica. Questa è variabile, ma generalmente pari a 10-14 gg, sebbene per diversi esperti vada protratta nelle infezioni da Gram-negativi a 21 giorni.
La durata dovrebbe comunque essere “ritagliata” sul singolo paziente, sulla base della risposta clinica e tollerabilità, delle alterazioni flogistiche iniziali del LCR e della loro normalizzazione, del profilo di sensibilità ai farmaci del patogeno, e della negativizzazione delle colture liquorali (1).
Ove non strettamente indicato, è preferibile evitare prelievi quotidiani di monitoraggio del LCR per limitare il rischio di sovrainfezione (1). Nei rari casi in cui la rimozione completa del device non sia possibile, potrebbe essere necessaria una terapia antimicrobica soppressiva a lungo termine (1).
Bibliografia
- Tunkel AR, Hasbun R, Bhimraj A, et al. 2017 Infectious Diseases Society of America’s Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clin Infect Dis. 2017;64(6):e34-e65.
- Pelegrín I, Lora-Tamayo J, Gómez-Junyent J, et al. Management of Ventriculoperitoneal Shunt Infections in Adults: Analysis of Risk Factors Associated With Treatment Failure. Clin Infect Dis 2017; 64:989.
- Dlouhy BJ, Reddy A, Dahdaleh NS, Greenlee JDW. Antibiotic impregnated catheter coverage of deep brain stimulation leads facilitates lead preservation after hardware infection. J Clin Neurosci 2012;19(10):1369-75.
- Nau R, Seele J, Djukic M, Eiffert H. Pharmacokinetics and pharmacodynamics of antibiotics in central nervous system infections. Curr Opin Infect Dis. 2018;31(1):57-68.
- Imberti R, Cusato M, Accetta G, et al. Pharmacokinetics of colistin in cerebrospinal fluid after intraventricular administration of colistin methanesulfonate. Antimicrob Agents Chemother. 2012;56(8):4416-4421.
- Cook, AM, Mieure, KD, Owen, RD, et al. Intracerebroventricular Administration of Drugs. Pharmacotherapy. 2009;29(7): 832–845.
- Beer R, Engelhardt KW, Pfausler B, et al. Pharmacokinetics of intravenous linezolid incerebrospinal fluid and plasma in neurointensive care patients with staphylococcalventriculitis associated with external ventricular drains. Antimicrob Agents Chemother2007;51:379-82.
- Pfausler B, Spiss H, Dittrich P, et al. Concentrations of fosfomycin in the cerebrospinal fluid of neurointensive care patients with ventriculostomy-associated ventriculitis. J Antimicrob Chemother. 2004;53(5):848-52.
- Kerz, T, von Loewenich, FD, Roberts J. et al. Cerebrospinal fluid penetration of very high-dose meropenem: a case report. Ann Clin Microbiol Antimicrob 2018;17:47.
- Mounier R, Lobo D, Hulin A, et al. Is first-line vancomycin still the best option to treat Staphylococcus health care-associated meningitis? World Neurosurg 2017;99:812.e811–812.e815.
- Pfausler B, Haring HP, Kampfl A, et al. Cerebrospinal fluid (CSF) pharmacokinetics of intraventricular vancomycin in patients with staphylococcal ventriculitis associated with external CSF drainage. Clin Infect Dis. 1997;25(3):733-5.
- Piva S, Di Paolo A, Galeotti L, et al. Daptomycin Plasma and CSF Levels in Patients with Healthcare-Associated Meningitis. Neurocrit Care. 2019;31(1):116-124.
- Mueller SW, Kiser TH, Anderson TA, Neumann RT. Intraventricular daptomycin and intravenous linezolid for the treatment of external ventricular-drainassociated ventriculitis due to vancomycin-resistant Enterococcus faecium. Ann Pharmacother. 2012;46(12):e35.
- Pandey S, Li L, Deng XY, et al. Outcome Following the Treatment of Ventriculitis Caused by Multi/Extensive Drug Resistance Gram Negative Bacilli; Acinetobacter baumannii and Klebsiella pneumonia. Front Neurol. 2019;9:1174.
- Bargiacchi O, De Rosa FG. Intrathecal or intraventricular colistin: a review. Le Infezioni in Medicina. 2016;1:3-11.






