Meropenem/vaborbactam è una nuova combinazione composta da un carbapenemico, meropenem, e un nuovo inibitore delle β-lattamasi a base di acido boronico ciclico, vaborbactam. L'aggiunta di vaborbactam a meropenem ripristina l'attività di quest’ultimo nei confronti degli Enterobacterales che producono enzimi Amber di classe A, particolarmente potente contro gli organismi produttori di KPC. Vaborbactam è anche in grado di ridurre le MIC di meropenem di Enterobacterales che hanno una ridotta suscettibilità a meropenem dovuta alla produzione di ESBL o di β-lattamasi di tipo AmpC in presenza di difetti di permeabilità. Tuttavia, non possiede attività nei confronti delle carbapenemasi Amber di classe B o D (metallo- β-lattamasi e enzimi OXA), né migliora l'attività di meropenem nei confronti dei bacilli Gram-negativi non fermentanti multiresistenti, in particolare Acinetobacter spp. e P. aeruginosa (1).
Meccanismo d’azione e resistenza
Meropenem è un antibiotico battericida che inibisce la sintesi della parete cellulare del peptidoglicano legandosi alle proteine leganti le penicilline (PBP) e inibendone l’attività. Vaborbactam è un inibitore non-beta-lattamico delle β -lattamasi che agisce formando un addotto covalente con le β-lattamatasi.
I meccanismi di resistenza batterica in grado di ridurre l’attività di meropenem/vaborbactam comprendono le mutazioni a carico delle porine che riducono la permeabilità della membrana esterna (porina OmpK35/36) e la sovraespressione delle pompe di efflusso. Meropenem/vaborbactam mantiene l'attività contro i ceppi che producono KPC mutanti che conferiscono resistenza a ceftazidime/avibactam (ad esempio, KPC-8, KPC-31).
EUCAST ha fornito un breakpoint clinico di suscettibilità pari a ≤8 mg/L per Enterobacterales e P. aeruginosa, mentre il CLSI pari a ≤4 mg/L solo per Enterobacterales (1).
Proprietà farmacodinamiche e farmacocinetiche
Vaborbactam e meropenem sono caratterizzati da un basso legame alle proteine plasmatiche (33% e 2%, rispettivamente). I rispettivi volumi di distribuzione nei pazienti sono risultati pari a 20,2 L e 18,6 L dopo la somministrazione di dosi di 2 g di meropenem/2 g di vaborbactam mediante infusione della durata di 3 ore ogni 8 ore, indicativi di un volume di distribuzione coerente con il compartimento liquido extracellulare. Le concentrazioni di meropenem e di vaborbactam nel liquido di rivestimento dell’epitelio bronchiale (ELF) umano sono rispettivamente 65% e 79% delle loro concentrazioni plasmatiche non legate (2).
L’emivita terminale (t ½) di meropenem e di vaborbactam è rispettivamente pari a 2,30 ore e 2,25 ore. Per entrambi i composti l’escrezione è principalmente renale, determinando concentrazioni elevate e terapeutiche nelle urine. Circa il 40-60% di una dose di meropenem viene escreta immodificata entro 24-48 ore e un ulteriore 25% viene recuperato come prodotto di idrolisi microbiologicamente inattivo. Il 75-95% circa di vaborbactam viene escreto in forma immodificata nelle urine nell’arco di 24-48 ore. La Cmax e l’AUC di meropenem e di vaborbactam risultano lineari nell’intervallo posologico 1-2 g per meropenem e 0,25-2 g per vaborbactam, quando somministrati in infusione endovenosa di 3 ore (2).
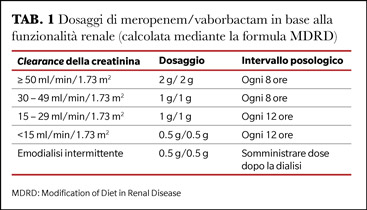 La clearance plasmatica di meropenem e vaborbactam si riduce con la diminuzione della funzionalità renale, rendendo necessari per entrambi la riduzione proporzionale della dose nei soggetti affetti da insufficienza renale (Tabella 1). Nei pazienti emodializzati, la dose deve essere somministrata dopo l'emodialisi (2).
La clearance plasmatica di meropenem e vaborbactam si riduce con la diminuzione della funzionalità renale, rendendo necessari per entrambi la riduzione proporzionale della dose nei soggetti affetti da insufficienza renale (Tabella 1). Nei pazienti emodializzati, la dose deve essere somministrata dopo l'emodialisi (2).
Vaborbactam, inibendo il CYP2D6, aumenta i livelli plasmatici di substrati del CYP2D6 (es. destrometorfano, desipramina, venlafaxina e metoprololo). Essendo meropenem un substrato di OAT1 e OAT3, compete con probenecid per la secrezione tubulare attiva e, a sua volta, probenecid inibisce l’escrezione renale di meropenem, pertanto la co-somministrazione dei 2 farmaci può provocare un aumento delle concentrazioni plasmatiche di meropenem. Inoltre la somministrazione concomitante di meropenem e acido valproico è stata associata a riduzioni delle concentrazioni di quest’ultimo.
Studi clinici
Meropenem/vaborbactam è stato approvato dalla Food and Drug Administration (FDA) nel 2017 come la prima combinazione di inibitori della β-lattamasi/carbapenemici ed è indicato per le infezioni complicate del tratto urinario (cUTI), inclusa la pielonefrite acuta (AP) negli adulti. Nel 2018 è stato approvato dalla European Medicines Agency (EMA) per cUTI e AP, infezioni intra-addominali complicate (cIAI), polmonite acquisita in ospedale (HAP), polmonite acquisita da ventilatore (VAP) e infezioni causate da organismi Gram-negativi aerobi negli adulti con opzioni di trattamento limitate.
Le approvazioni si sono basate sui dati di due trial clinici randomizzati di fase 3. Nello studio TANGO I sono stati arruolati 550 pazienti adulti che hanno effettuato terapia con meropenem/vaborbactam e con piperacillina/tazobactam per il trattamento di cUTI, inclusa la pielonefrite. I patogeni più comuni erano Enterobacterales (di cui 29% ESBL) e P. aeruginosa. Lo studio ha documentato la non inferiorità di meropenem/vaborbactam rispetto a piperacillina/tazobactam per il trattamento di cUTI. Nello specifico il successo terapeutico, definito come cura o miglioramento clinico ed eradicazione microbiologica, è stato pari al 98,4% nel braccio di meropenem/vaborbactam vs 94,0% nel braccio di piperacillina/tazobactam. L'analisi dei sottogruppi ha mostrato tassi di successo clinico significativamente più elevati con meropenem/vaborbactam nei pazienti di età ≥ 65 anni, nelle donne, nei pazienti senza sepsi o batteriemia e nei pazienti con punteggi di comorbidità Charlson più elevati (≥3). Non è stata osservata nessuna differenza tra meropenem/vaborbactam e piperacillina/tazobactam in termini di insorgenza di eventi avversi (3).
Il trial clinico TANGO II ha incluso 77 pazienti con infezioni da CRE (UTI, HAP/VAP, cIAI, BSI) randomizzati 2:1 per ricevere meropenem/vaborbactam in monoterapia (n=52) o best available therapy (BAT) (n=25). Tra questi, 47 (32 meropenem/vaborbactam; 15 BAT) avevano un'infezione microbiologicamente confermata causata da un isolato CRE, e K. pneumoniae. KPC era il patogeno più comune (87% [41/47]). Questo trial è stato il primo studio che ha messo a confronto diretto meropenem/vaborbactam e BAT in pazienti con infezioni da CRE microbiologicamente confermate.
Lo studio ha dimostrato che il nuovo farmaco è più sicuro e più efficace della BAT per il trattamento delle infezioni causate da CRE, soprattutto nei pazienti immunocompromessi. Gli eventi avversi si sono verificati in una media inferiore nei pazienti trattati con meropenem/vaborbactam rispetto a BAT (4).
Un’analisi post-hoc del trial TANGO II è stata condotta analizzando il sottogruppo di pazienti senza precedente fallimento antimicrobico (22 trattati con meropenem/vaborbactam e 15 con BAT), dal momento che nel trial i pazienti con precedente fallimento antimicrobico sono stati arruolati esclusivamente nel braccio meropenem/vaborbactam. Dall’analisi è emerso che la terapia di prima linea con meropenem/vaborbactam è associata a un aumento del 42,9% della guarigione clinica e una riduzione del 29% della mortalità rispetto a BAT, mostrando variazioni maggiori rispetto a quelli osservati nel TANGO II (5).
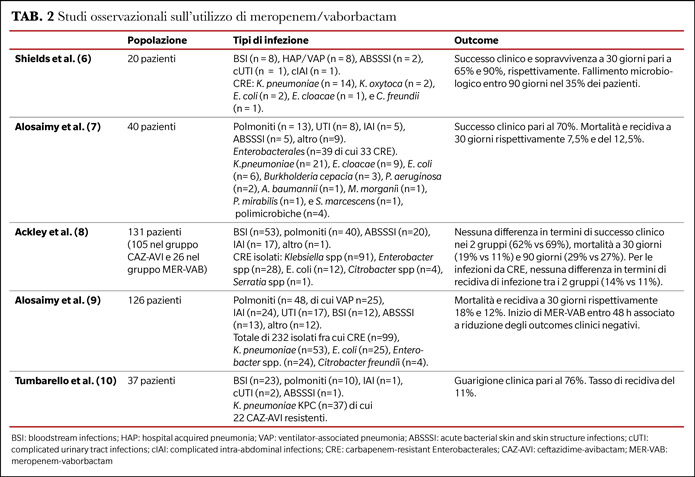
Le evidenze sull'uso nella pratica clinica di meropenem/vaborbactam sono limitate e basate esclusivamente su studi osservazionali, che confermano la sua efficacia e sicurezza nel trattamento delle infezioni da CRE e negli isolati resistenti a ceftazidime/avibactam (6-10) (Tabella 2).
Conclusioni
Il trial clinico TANGO II e i dati clinici emergenti riguardanti l’utilizzo real-life di meropenem/vaborbactam sembrano suggerire un promettente utilizzo di questo nuovo antibiotico per il trattamento delle infezioni gravi da KPC-CRE microbiologicamente confermate. Inoltre meropenem/vaborbactam, grazie alla sua buona penetrazione nell’ELF, rappresenta una valida opzione terapeutica per il trattamento delle infezioni polmonari dovute a CRE. I dati al momento disponibili sull’efficacia di meropenem/vaborbactam nel trattamento di infezioni causate da isolati di KPC-Kp resistenti a ceftazidime/avibactam, associati alla crescente emergenza di tali patogeni, ne supportano ulteriormente l’utilizzo nella pratica clinica.
- Novelli A, Del Giacomo P, Rossolini GM, Tumbarello M. Meropenem/vaborbactam: a next generation β-lactam β-lactamase inhibitor combination. Expert Rev Anti Infect Ther. 2020;18(7):643-655.
- Wenzler E, Scoble PJ. An Appraisal of the Pharmacokinetic and Pharmacodynamic Properties of Meropenem-Vaborbactam. Infect Dis Ther. 2020;9(4):769-784.
- Kaye KS, Bhowmick T, Metallidis S, et al. Effect of Meropenem-Vaborbactam vs Piperacillin-Tazobactam on Clinical Cure or Improvement and Microbial Eradication in Complicated Urinary Tract Infection: The TANGO I Randomized Clinical Trial. JAMA. 2018;319(8):788-799.
- Wunderink RG, Giamarellos-Bourboulis EJ, Rahav G, et al. Effect and Safety of Meropenem-Vaborbactam versus Best-Available Therapy in Patients with Carbapenem-Resistant Enterobacteriaceae Infections: The TANGO II Randomized Clinical Trial. Infect Dis Ther. 2018;7(4):439-455.
- Bassetti M, Giacobbe DR, Patel N, et al. Efficacy and Safety of Meropenem-Vaborbactam Versus Best Available Therapy for the Treatment of Carbapenem-Resistant Enterobacteriaceae Infections in Patients Without Prior Antimicrobial Failure: A Post Hoc Analysis. Adv Ther. 2019;36(7):1771-1777.
- Shields RK, McCreary EK, Marini RV, et al. Early Experience with Meropenem-Vaborbactam for Treatment of Carbapenem-Resistant Enterobacteriaceae Infections. Clin. Infect. Dis. 2020;71:667-671.
- Alosaimy S, Jorgensen SCJ, Lagnf AM, et al. Real-World Multicenter Analysis of Clinical Outcomes and Safety of Meropenem-Vaborbactam in Patients Treated for Serious Gram-Negative Bacterial Infections. Open Forum Infect. Dis. 2020, 7, ofaa051.
- Ackley R, Roshdy D, Meredith J, et al. Meropenem-Vaborbactam versus Ceftazidime-Avibactam for Treatment of Carbapenem-Resistant Infections. Antimicrob. Agents Chemother. 2020;64:e02313-19.
- Alosaimy S, Lagnf AM, Morrisette T, et al. Real-world, Multicenter Experience With Meropenem-Vaborbactam for Gram-Negative Bacterial Infections Including Carbapenem-Resistant Enterobacterales and Pseudomonas aeruginosa. Open Forum Infect Dis. 2021;8(8):ofab371.
- Tumbarello M, Raffaelli F, Cascio A, et al. Compassionate use of meropenem/vaborbactam for infections caused by KPC-producing Klebsiella pneumoniae: a multicentre study. JAC Antimicrob Resist. 2022;4(1):dlac022.






