L’entrata di HIV nella cellula ospite un processo complesso, che comprende in maniera sequenziale: attacco e legame al recettore CD4, legame al co-recettore CCR5 o CXCR4 e la fusione delle membrane cellula-virus. Gli inibitori dell’entry (EI) sono un gruppo eterogeneo di composti con un diverso meccanismo d’azione (MoA), che dipende da quale fase del ciclo virale di HIV hannocome obiettivo. Questa classe di farmaci continua ad attirare l’attenzione dei medici e dei pazienti con infezione da HIV (PLWH) e sta progressivamente entrando in pratica clinica, inizialmente per i soggetti con ridotte opzioni terapeutiche.
Meccanismo d'azione (Figura 1)
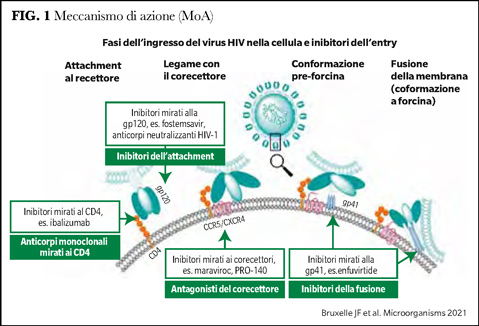 L’interazione iniziale tra HIV e la cellula target prevede legami elettrostatici non specifici tra i domini a carica positiva sulla gp120 e domini a carica negativa sulla superficie della cellula ospite o attraverso interazioni specifiche tra proteine dell’ospite incorporate nella membrana virale e i loro ligandi sulla cellula target. In questa fase iniziale gli EI bloccano il legame tra gp120 e CD4 e sono fostemsavir (precedentemente noto come BMS-663068) sul versante gp120 ed ibalizumab sul versante CD4.
L’interazione iniziale tra HIV e la cellula target prevede legami elettrostatici non specifici tra i domini a carica positiva sulla gp120 e domini a carica negativa sulla superficie della cellula ospite o attraverso interazioni specifiche tra proteine dell’ospite incorporate nella membrana virale e i loro ligandi sulla cellula target. In questa fase iniziale gli EI bloccano il legame tra gp120 e CD4 e sono fostemsavir (precedentemente noto come BMS-663068) sul versante gp120 ed ibalizumab sul versante CD4.
Successivamente ha luogo il legame con i co-recettori, di cui i principali sono CCR5 e CXCR4, che appartengono alla classe dei recettori accoppiati alla proteina G e possiedono un estremo N-terminale ed un estremo C-terminale. La loro entrata in gioco nel legame con HIV avviene successivamente all’interazione gp120-CD4. è noto che CCR5 consente l'ingresso di ceppi macrofago-tropici di HIV, mentre CXCR4 è il recettore che promuove l'ingresso di ceppi linfocito-tropici di HIV.
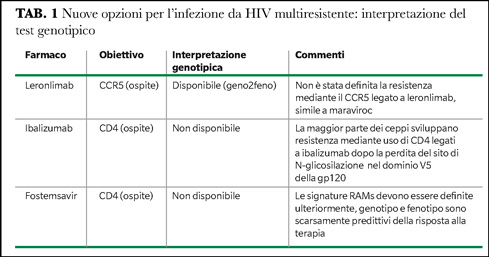
Sono stati condotti diversi approcci terapeutici sia verso CCR5 che CXCR4, tuttavia le strategie terapeutiche attuali considerano esclusivamente CCR5. Il farmaco prototipico, che agisce come antagonista del recettore CCR5, è maraviroc, mentre recentemente stato sintetizzato un altro composto che agisce come anticorpo monoclonale diretto verso CCR5, leronlimab (anche noto come PRO 140).
 Il legame della proteina gp120 al co-recettore induce un secondo cambiamento nella conformazione della membrana virale che porta all’esposizione della proteina fusogena gp41 ed al suo inserimento nella membrana della cellula ospite. Ciò determina la fusione tra le 2 membrane virus-cellula ed era inizialmente il target dell’inibitore di gp41 enfuvirtide (anche noto come T-20).
Il legame della proteina gp120 al co-recettore induce un secondo cambiamento nella conformazione della membrana virale che porta all’esposizione della proteina fusogena gp41 ed al suo inserimento nella membrana della cellula ospite. Ciò determina la fusione tra le 2 membrane virus-cellula ed era inizialmente il target dell’inibitore di gp41 enfuvirtide (anche noto come T-20).
Il problema che accomuna gli EI di prima generazione (maraviroc ed enfuvirtide) è lo sviluppo di resistenze, genotipiche o fenotipiche, che possono ridurre l’efficacia del farmaco in vivo, mentre per gli EI di seconda generazione (fostemsavir, ibalizumab e leronlimab) non è stato ancora definito l’esatto meccanismo di resistenza tramite cui HIV sfugge al controllo del farmaco. Inoltre, mancano gli strumenti tecnici per la definizione di questa resistenza (Tabella 1).
Gli EI di prima generazione
Maraviroc è il solo antagonista del co-recettore CCR5 che ha accumulato un’estesa esperienza clinica sia nei soggetti naive che drug-experienced. Per l’impiego di maraviroc è necessario eseguire il saggio del tropismo virale per determinare l’uso, anche non esclusivo, di CCR5 da parte di HIV. I trial MOTIVATE 1 e 2 hanno arruolato soggetti che avevano precedentemente ricevuto almeno 3 classi di farmaci antiretrovirali. Questi soggetti ricevevano un regime di background ottimizzato (OBR) sui test di resistenza e maraviroc o placebo. I soggetti nel gruppo maraviroc mostravano riduzioni di HIV-RNA significativamente maggiori, raggiungevano maggiormente un livello di HIV-RNA non rilevabile ed avevano un aumento maggiore di linfociti CD4 rispetto ai soggetti che ricevevano placebo (1). Il meccanismo di resistenza a maraviroc si realizza tramite l’insorgenza di ceppi virali CXCR4-tropici o dual-mixed, che non rispondono in vitro anche alle massime concentrazioni del farmaco. Maraviroc era stato inizialmente impiegato nei soggetti immunological non-responders, nelle prime serie di casi trattati con un certo successo (2, 3), indicazione successivamente abbandonata nella pratica clinica.
Enfuvirtide ha avuto la sua dimostrazione di efficacia negli individui HTE mediante gli studi TORO 1 e 2, che hanno mostrato un vantaggio dell’aggiungere questo EI ad un regime terapeutico basato sul test di resistenza rispetto al gruppo che riceveva placebo (4,5). Questo farmaco, anche se molto efficace sia virologicamente che immunologicamente, è scarsamente usato in pratica clinica in quanto poco maneggevole perché richiede la somministrazione due volte al giorno per via sottocutanea. HIV sviluppa la resistenza nei confronti di enfuvirtide attraverso mutazioni nella gp41: G36D/E/S, I37T/N/V, V38A/E/M, Q39R, Q40H, N42T e N43D/K/S (6).
Gli EI di seconda generazione
I tre composti di nuova generazione (fostemsavir, ibalizumab e leronlimab) inibiscono tre diversi passaggi-chiave nel processo di entrata di HIV nella cellula ospite.
Fostemsavir è un profarmaco che viene trasformato nella molecola attiva temsavir mediante un processo di idrolisi. Temsavir previene l’attacco di HIV al recettore CD4 attraverso il legame con la glicoproteina gp120 sull’envelope virale, determinandone il blocco nella posizione chiusa e così prevenendo l’interazione di HIV con le cellule CD4-positive. Alcuni sottotipi di HIV sono costitutivamente meno suscettibili a temsavir, quali ad esempio CRF01_AE o altri virus ricombinanti, principalmente correlati al sottotipo F (7). La notizia positiva è che la suscettibilità in vitro a fostemsavir è conservata nonostante la lunga esposizione ai farmaci antiretrovirali nei soggetti HTE che albergano isolati MDR (8). Parallelamente, l’esame degli isolati di HIV con breakthrough virale negli studi MOTIVATE ha evidenziato che la resistenza fenotipica a maraviroc non correlava con quella a temsavir (9). L’efficacia di fostemsavir è stata dimostrata dallo studio BRIGHTE. Questo studio ha arruolato due coorti di pazienti: una coorte randomizzata versus placebo, composta da soggetti con ancora qualche opzione terapeutica, sebbene non in grado di costruire un regime pienamente attivo con i farmaci disponibili, e una coorte non randomizzata, costituita da soggetti senza classi farmacologiche attive. Quando fostemsavir è stato aggiunto all’OBR il 60% dei soggetti della coorte randomizzata ed
il 37% della coorte non randomizzata hanno raggiunto valori di HIV-RNA <40 cp/mL alla settimana 96 (10).
Successivamenteè stato dimostrato che questa risposta virologica era associata significativamente allo score di suscettibilità fenotipica ai nuovi farmaci contenuti nell’OBR (OSS-new) (11). Molteplici mutazioni nella gp120 sono state descritte in letteratura in associazione con lo sviluppo di resistenza a fostemsavir, ma un test validato di resistenza per la gp120 non è al momento disponibile.
Ibalizumab è un anticorpo monoclonale umanizzato appartenente alla classe delle immunoglobuline IgG4 che si lega in modo non competitivo al secondo dominio del recettore CD4 dopo il processo di attacco di HIV, impedendo così la fusione delle membrane e l’entrata del virus nella cellula ospite. Ibalizumab è somministrato, insieme all’OBR, per via endovenosa ogni 14 giorni. Il farmaco è stato studiato nel trial TMB-301 in cui è stato somministrato a soggetti HTE, che mostravano una resistenza genotipica ad almeno un componente di tre classi farmacologiche ed erano in fallimento virologico. Alla settimana 25 dello studio la riduzione media di HIV-RNA è stata di 1.6 log10 cp/mL dal baseline, il 43% dei soggetti mostrava HIV-RNA <50 cp/mL e il 50% HIV-RNA <200 cp/mL, 10/40 soggetti (popolazione ITT) mostravano fallimento virologico e 9/10 avevano una ridotta suscettibilità a ibalizumab rispetto al baseline (12). Il protocollo di accesso allargato TMB-311, condotto sino alla settimana 96, ha evidenziato che i soggetti con più farmaci attivi (1 o 2) raggiungevano HIV-RNA <50 cp/mL, secondo l’analisi on-treatment, con maggiore frequenza rispetto a chi non aveva farmaci attivi nell’OBR.
Leronlimab (PRO 140) è un anticorpo monoclonale umanizzato in grado di interagire in maniera specifica con il co-recettore CCR5. è stato studiato nell’infezione da HIV (trial fase III), nella NASH (trials in corso) e, come uso compassionevole, nell’infezione da SARSCoV-2. Nei confronti di HIV è attivo in vitro a concentrazioni sub-nanomolari, paragonabili a quelle necessarie per un isolato prototipico macrofago-tropico, e non influenzabili dalla terapia precedente o attuale con maraviroc (13). In vivo è prevista la somministrazione per via sottocutanea auto-somministrata, al momento nei soggetti con ridotte opzioni terapeutiche.
Conclusioni
Lo sviluppo degli EI ha sempre riscosso molto interesse nei ricercatori e nei clinici, per via del loro meccanismo d’azione molto variegato e scientificamente interessante.
Gli EI di ultima generazione sembrano avere un profilo di sicurezza ed efficacia estremamente valido e potenzialmente potrebbero essere sviluppati come composti a lunga durata d’azione.
- Gulick RM, Lalezari J, Goodrich J, et al. Maraviroc for previously treated patients with R5 HIV-1 infection. N Engl J Med. 2008;359(14):1429-41.
- Cuzin L, Trabelsi S, Delobel P, et al. Maraviroc intensification of stable antiviral therapy in HIV-1-infected patients with poor immune restoration: MARIMUNO-ANRS 145 study. J Acquir Immune Defic Syndr. 2012;61(5):557-64.
- Rusconi S, Vitiello P, Adorni F, et al. Maraviroc as intensification strategy in HIV-1 positive patients with deficient immunological response: an Italian randomized clinical trial. PLoS One. 2013;8(11):e80157.
- Lalezari JP, Henry K, O'Hearn M, et al. Enfuvirtide, an HIV-1 fusion inhibitor, for drug-resistant HIV infection in North and South America. N Engl J Med. 2003;348(22):2175-85.
- Lazzarin A, Clotet B, Cooper D, et al. Efficacy of enfuvirtide in patients infected with drug-resistant HIV-1 in Europe and Australia. N. Engl. J. Med. 2003; 348:2186-2195.
- Reeves JD, Lee F-H, Miamidian JL, et al. Enfuvirtide resistance mutations: impact on human immunodeficiency virus envelope function, entry inhibitor sensitivity, and virus neutralization. J Virol. 2005;79(8):4991-9.
- Gartland M, Arnoult E, Foley BT, et al. Prevalence of gp160 polymorphisms known to be related to decreased susceptibility to temsavir in different subtypes of HIV-1 in the Los Alamos National Laboratory HIV Sequence Database, J Antimicrob Chemother. 2021;76(11);2958–2964.
- Saladini F, Giannini A, Giammarino F, et al. In vitro susceptibility to fostemsavir is not affected by long-term exposure to antiviral therapy in MDR HIV-1-infected patients. J Antimicrob Chemother. 2020;75(9):2547-2553.
- Rose R, Gartland M, Li Z, et al., Clinical evidence for a lack of cross-resistance between temsavir and ibalizumab or maraviroc. AIDS 2022;36(1):11-18.
- Lataillade M, Lalezari JP, Kozal M, et al. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in heavily treatment-experienced individuals: week 96 results of the phase 3 BRIGHTE study. Lancet HIV. 2020;7(11):e740-e751.
- Ackerman P, Thompson M, Molina J-M, et al. Long-term efficacy and safety of fostemsavir among subgroups of heavily treatment-experienced adults with HIV-1. AIDS. 2021;35(7):1061-1072.
- Emu B, Fessel J, Schrader S, et al. Phase 3 study of ibalizumab for multidrug-resistant HIV-1. N Engl J Med. 2018; 379(7):645-654.
- Rusconi S, Saladini F, Bellocchi MC, et al. Leronlimab (PRO 140) in vitro activity against 4-class drug resistant HIV-1 from heavily treatment experienced subjects. Pharmacol Res. 2022;176:106064.






