 L'epidemiologia delle infezioni fungine invasive è cambiata negli ultimi due decenni, con la disponibilità della profilassi antimicotica ad ampio spettro che riduce la prevalenza e migliora la sopravvivenza dei pazienti con fattori di rischio tradizionali. La pressione selettiva della profilassi antimicotica, così come i progressi nei test molecolari, hanno contribuito all'emergere di patogeni fungini precedentemente meno comuni, inclusi lieviti e muffe rare che sono spesso resistenti alle classi di antimicotici attualmente disponibili (azoli, echinocandine e polieni). L’emergenza di Candida auris, così come di isolati di Aspergillus fumigatus resistenti agli azoli rappresentano ulteriori minacce al nostro attuale armamentario antimicotico (1). Nonostante la necessità di più opzioni terapeutiche, nell’ultimo decennio è stato approvato solo isavuconazolo. Il panorama terapeutico antimicotico ci propone fortunatamente alcune molecole innovative sia in termini di meccanismo d’azione che di modalità di somministrazione (Tabelle 1 e 2).
L'epidemiologia delle infezioni fungine invasive è cambiata negli ultimi due decenni, con la disponibilità della profilassi antimicotica ad ampio spettro che riduce la prevalenza e migliora la sopravvivenza dei pazienti con fattori di rischio tradizionali. La pressione selettiva della profilassi antimicotica, così come i progressi nei test molecolari, hanno contribuito all'emergere di patogeni fungini precedentemente meno comuni, inclusi lieviti e muffe rare che sono spesso resistenti alle classi di antimicotici attualmente disponibili (azoli, echinocandine e polieni). L’emergenza di Candida auris, così come di isolati di Aspergillus fumigatus resistenti agli azoli rappresentano ulteriori minacce al nostro attuale armamentario antimicotico (1). Nonostante la necessità di più opzioni terapeutiche, nell’ultimo decennio è stato approvato solo isavuconazolo. Il panorama terapeutico antimicotico ci propone fortunatamente alcune molecole innovative sia in termini di meccanismo d’azione che di modalità di somministrazione (Tabelle 1 e 2).
Fosmanogepix
(Fos)manogepix inibisce l'enzima aciltransferasi, Gwt1, che è un componente importante della via di maturazione delle proteine ancorate al glicosilfosfatidilinositolo (GPI), ed è essenziale per il traffico delle mannoproteine tra la membrana e la parete fungina. Clinicamente, manogepix viene somministrato come profarmaco, N-fosfonoossimetilico, fosmanogepix (APX001), che viene rapidamente convertito in manogepix dalle fosfatasi dell'ospite (1,2).
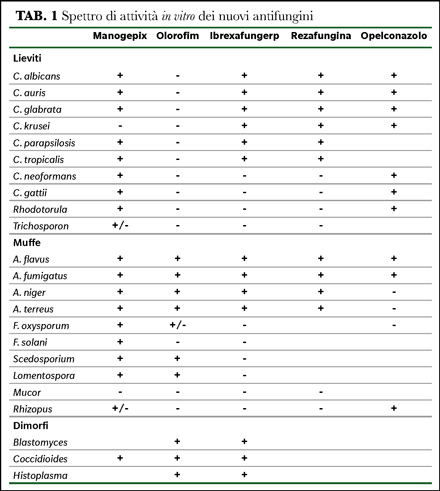
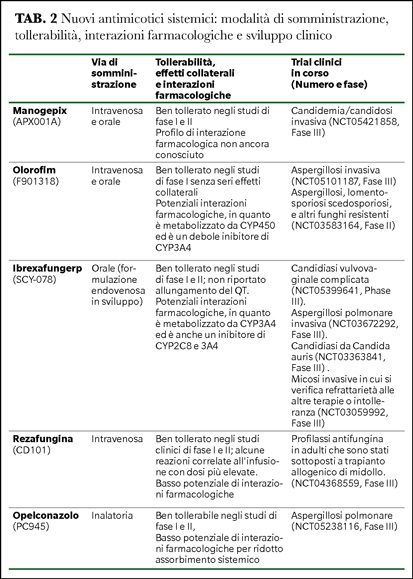 Manogepix possiede un’attività in vitro nei confronti di un’ampia varietà di miceti: Candida spp. (con eccezione di C. krusei), Cryptococcus spp., Aspergillus spp., Fusarium spp. e Scedosporium apiospermum e Lomentospora prolificans. Come le echinocandine, manogepix non inibisce necessariamente la crescita dei funghi filamentosi, ma piuttosto provoca cambiamenti morfologici. La resistenza a manogepix può svilupparsi a causa di mutazioni puntiformi che portano a sostituzioni aminoacidiche di Gwt1 e questi cambiamenti non influenzano l'attività di altri antimicotici, come gli azoli e le echinocandine (1,2). Il farmaco ha dimostrato una ottima tollerabilità negli studi clinici di Fase I e II, con solo lievi effetti avversi segnalati (3,4), ha uno sviluppo orale ed endovenoso.
Manogepix possiede un’attività in vitro nei confronti di un’ampia varietà di miceti: Candida spp. (con eccezione di C. krusei), Cryptococcus spp., Aspergillus spp., Fusarium spp. e Scedosporium apiospermum e Lomentospora prolificans. Come le echinocandine, manogepix non inibisce necessariamente la crescita dei funghi filamentosi, ma piuttosto provoca cambiamenti morfologici. La resistenza a manogepix può svilupparsi a causa di mutazioni puntiformi che portano a sostituzioni aminoacidiche di Gwt1 e questi cambiamenti non influenzano l'attività di altri antimicotici, come gli azoli e le echinocandine (1,2). Il farmaco ha dimostrato una ottima tollerabilità negli studi clinici di Fase I e II, con solo lievi effetti avversi segnalati (3,4), ha uno sviluppo orale ed endovenoso.
Olorofim
Olorofim (F901318, classe orotomide) inibisce reversibilmente l'enzima diidroorotato deidrogenasi (DHODH), che è coinvolto nella biosintesi della pirimidina provocando l'arresto del ciclo cellulare e la lisi cellulare. In Aspergillus, inoltre, provoca l'inibizione della germinazione dei conidi, rallentamento della crescita del tubo germinale e dell'ifa, lisi ifale e, infine, la morte cellulare dopo esposizione prolungata (120 h), suggerendo che i suoi effetti cambiano da fungistatici a fungicidi con esposizioni più lunghe (1,2).
Lo spettro di attività di olorofim è unico. Dimostra una potente attività contro diverse muffe patogene e funghi dimorfici, comprese le specie Blastomyces, Coccidioides e Histoplasma, ma è privo di attività contro Mucorales e lieviti. Nonostante la mancanza di attività contro diversi importanti gruppi patogeni e attività non omogenea verso le muffe, olorofim ha dimostrato un'attività promettente contro diversi funghi che mostrano resistenza agli azoli e all'amfotericina B. Olorofim ha anche dimostrato efficacia in vivo in diversi modelli sperimentali di infezioni fungine invasive, inclusa l'aspergillosi invasiva causata da diverse specie di Aspergillus, coccidioidomicosi del Sistema Nervoso Centrale, scedosporiosi e lomentosporiosi disseminata (1,2). Negli studi clinici di Fase I non sono stati osservati effetti avversi gravi (5). Olorofim subisce un metabolismo epatico da parte di diversi enzimi CYP450 e agisce anche come un debole inibitore del CYP3A4. Pertanto, le interazioni farmacologiche possono essere un problema clinico. Il farmaco ha uno sviluppo orale ed endovenoso.
Ibrexafungerp
Ibrexafungerp (SCY-078, classe triterpenoide) è un composto semisintetico derivato dal prodotto naturale, enfumafungin: ibrexafungerp inibisce la produzione di 1,3-β-D-glucano attraverso l'inibizione non competitiva del complesso 1,3-β-D-glucano sintasi, indebolendo la parete cellulare e provocando instabilità osmotica ed eventuale lisi cellulare, analogamente alle echinocandine. Tuttavia, i siti di legame per ibrexafungerp e echinocandine si sovrappongono solo parzialmente; quindi, la resistenza crociata tra queste due classi di antimicotici è limitata. Inoltre, a differenza delle echinocandine, ibrexafungerp può essere assorbito dal tratto gastrointestinale dopo somministrazione orale. Ha attività in vitro contro diverse specie di Candida, tra cui C. auris, contro cui è stata anche dimostrata l'attività verso il biofilm. La sua attività viene mantenuta anche contro gli isolati resistenti agli azoli. Ibrexafungerp mostra attività contro specie di Aspergillus mentre non è attivo verso Mucorales e Fusarium (1).
Negli studi clinici di Fase I e II, ibrexafungerp è stato ben tollerato, sebbene gli effetti avversi non gravi siano aumentati con dosi più elevate e durata più lunga della terapia. Gli effetti avversi da lievi a moderati più comuni includevano nausea, vomito, diarrea e dolore addominale (6,7). Viene metabolizzato dal CYP3A4 e la somministrazione concomitante di potenti induttori o inibitori di questo enzima deve essere evitata, poiché questi possono portare rispettivamente a concentrazioni insufficienti o sovraterapeutiche. Il farmaco ha uno sviluppo orale ed endovenoso (1).
Rezafungina
Rezafungina (CD101) è un'echinocandina di seconda generazione e, analogamente ad altre echinocandine, provoca l'inibizione non competitiva del complesso enzimatico 1,3-β-D-glucano sintasi. Rezafungina rappresenta un derivato dell’anidulafungina in cui la modificazione di un gruppo chimico dell’anello principale ne determina una maggiore stabilità ed emivita (~ 130 h contro ~ 24 h per anidulafungina) permettendo la somministrazione settimanale. Come con le altre echinocandine, rezafungina ha una potente attività in vitro contro le specie Candida e Aspergillus e una attività ridotta nei confronti della C. parapsilosis mentre è inattiva nei confronti di Cryptococcus spp. (1,2). Questa classe è molto ben tollerata. Nei volontari sani, la maggior parte degli effetti avversi è stata lieve e transitoria. Rezafungina ha un basso potenziale di interazioni farmaco-farmaco e sono state osservate interazioni minime con gli enzimi CYP450 ricombinanti in vitro (6). Data la lunga emivita, particolarmente interessante sembra essere il suo impiego clinico in profilassi. Il farmaco, come le altre echinocandine, ha uno sviluppo endovenoso.
Opelconazolo
Opelconazolo (PC945, sviluppato da Pulmocide Ltd., UK) è un triazolo ad ampio spettro a sviluppo inalatorio. Dopo l'inalazione, mostra efficacia principalmente nei polmoni (le concentrazioni sistemiche sono minime), rendendolo un agente promettente per il trattamento dell'aspergillosi polmonare in pazienti non neutropenici senza infezione disseminata (2). Le sue caratteristiche chimico-fisiche determinano elevate concentrazioni locali, ritenzione polmonare prolungata, lento assorbimento dal polmone e, di conseguenza, basse concentrazioni plasmatiche. Questi risultati sono promettenti dato il basso potenziale di effetti avversi sistemici e interazioni farmacologiche. Inoltre, alcuni dati suggeriscono la persistenza cellulare nelle cellule immunitarie ed epiteliali locali, che è potenzialmente utile in termini di utilizzo nella profilassi o nel potenziamento dell'attività antimicotica. Opelconazolo mostra un'attività antimicotica ad ampio spettro contro lieviti e muffe (9).
Vi sono oggi molteplici agenti antimicotici promettenti in fase di sviluppo clinico avanzato. Questa revisione mette in evidenza i candidati più avanzati e promettenti per l'approvazione normativa tempestiva. Questi trattamenti antimicotici offrono vantaggi significativi in termini di spettro di attività, tollerabilità, interazioni farmaco-farmaco e/o via di somministrazione che hanno il potenziale di modificare significativamente il campo della micologia clinica in un prossimo futuro.
- Wiederhold NP. Pharmacodynamics, Mechanisms of Action and Resistance, and Spectrum of Activity of New Antifungal Agents. J Fungi (Basel). 2022;8(8):857.
- Hoenig lM, Sprute R, Egger M et al. The Antifungal Pipeline: Fosmanogepix, Ibrexafungerp, Olorofm, Opelconazole, and Rezafungin. Drugs. 2021; 81:1703–1729.
- Hodges MR, Ople E, Shaw KS et al. Phase 1 Study to Assess Safety, Tolerability and Pharmacokinetics of Single and Multiple Oral Doses of APX001 and to Investigate the Effect of Food on APX001 Bioavailability. Open Forum Infect. Dis. 2017, 4, S534.
- Bulpa P, Rahav G, Oren I et al. Clinical Safety and Efficacy of Fosmanogepix, a Novel First-in-class Antifungal, in Patients with Renal Insufficiency: Subset Analysis from a Phase 2 Candidemia Trial. In Proceedings of the Programs and Abstracts of the 55th Annual Infectious Diseases Society of America (IDSA) Meeting, Philadelphia, PA, USA, 21–25 October 2020. IDWeek 2020.
- Kennedy T, Allen G, Steiner J et al. Assessment of the duration of infusion on the tolerability and repeat dose pharmacokinetics of F901318 in healthy volunteers (abstr. P1711). In Proceedings of the 27th European Congress of Clinical Microbiology and Infectious Diseases, Vienna, Austria, 22–25 April 2017.
- Trucksis M, Garrett G, Heriman I. A phase I multiple rising dose study evaluating safety, tolerability, and pharmacokinetics of MK-3118, oral glucan synthase inhibitor, in healthy volunteers. In Proceedings of the 51st Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC), Chicago, IL, USA, 17–20 September 2011.
- Spec A, Pullman J, Thompson GR et al. MSG-10: A Phase 2 study of oral ibrexafungerp (SCY-078) following initial echinocandin therapy in non-neutropenic patients with invasive candidiasis. J. Antimicrob. Chemother. 2019, 74, 3056–3062.
- Thompson GR, Soriano A, Skoutelis A et al. Rezafungin versus Caspofungin in a Phase 2, Randomized, Double-Blind Study for the Treatment of Candidemia and Invasive Candidiasis-The STRIVE Trial. Clin. Infect. Dis. 2021, 73, 561–562.
- Cass L, Murray A, Davis A et al. Safety and nonclinical and clinical pharmacokinetics of PC945, a novel inhaled triazole antifungal agent. Pharmacol Res Perspect. 2021;9(1):e00690.






