Il virus dell’epatite D (HDV) è la terza causa di epatopatia virale, dopo HBV e HCV. Si tratta di un virus difettivo che necessita per il suo ciclo vitale di una concomitante infezione con HBV. L’esposizione a HDV è confermata dalla presenza di anticorpi contro l’antigene HD (HD-Ag) e la diagnosi di infezione da HDV si basa sulla presenza di HDV RNA nel sangue (1).
Tre recenti metanalisi hanno stimato che il numero di portatori di HBsAg coinfetti con HDV sia compreso tra 12 e 72 milioni (2). L’epidemiologia, peraltro, è mutata con l’avvento della vaccinazione anti HBV soprattutto nei Paesi sviluppati, tuttavia l’infezione sta riemergendo con l’immigrazione di soggetti da aree endemiche (Africa, Asia).
Il decorso clinico della malattia HDV relata è più aggressivo rispetto a HBV e HCV. Oltre il 90% dei portatori di HBsAg coinfetti con HDV sviluppa una epatite cronica D che determina cirrosi nel 50-70% dei casi nell’arco di 5-10 anni, con un rischio 3 volte maggiore rispetto alla monoinfezione da HBV. A causa dell’andamento clinico rapido, i pazienti affetti da cirrosi HDV sono più giovani rispetto a HBV e HCV e la morte è spesso conseguente a scompenso epatico più che a epatocarcinoma (HCC).
Il solo trattamento disponibile finora per HDV è stato l’interferone che consente di ottenere tassi di risposta subottimali e spesso non duraturi. Il trapianto di fegato (LT) rappresenta quindi l’unica opzione terapeutica per molti pazienti.
Trapianto di fegato per HDV: evoluzione e risultati
Nel 1987 vennero trapiantati con successo in Italia 7 pazienti affetti da cirrosi HDV, tuttavia l’infezione virale, determinata dal riscontro di HD-Ag nell’organo, si verificò nel 70% dei casi (3). Nel 1991 in una serie italo-belga di trapianti per HDV, la reinfezione si verificò nell’80% dei casi, con un decorso per lo più lieve ed un tasso di sopravvivenza del 78%. Quest’ultimo studio ha messo in evidenza la discrepanza tra l’alto tasso di reinfezione dell’organo e la pressoché assenza di recidiva di malattia, spiegabile con una infezione subclinica di HDV che può diventare clinicamente rilevante solo in presenza di una riattivazione di HBV.
Il ruolo di HBV nella recrudescenza della malattia da HDV è stato confermato da Samuel e coll. nel 1993, in uno studio multicentrico europeo che arruolò i pazienti HBsAg positivi sottoposti a trapianto epatico (LT) (4). Tale studio dimostrò che:
- il tasso di reinfezione virale era inferiore nei pazienti HDV rispetto agli HBV per la frequente assenza di HBV DNA plasmatico nei pazienti HDV al momento del trapianto, e
- le immunoglobuline anti HBsAg (HBIg) erano in grado di ridurre ulteriormente il rischio di reinfezione HDV, potenziando il controllo della viremia HBV.
Analogamente alla storia naturale da HDV, il fegato trapiantato si reinfetta con le particelle HBV/HDV residue nel sangue del ricevente. Trattasi di un processo sequenziale in cui HBV deve per primo stabilire l’infezione dell’organo per consentire l’espressione successiva di HDV; pertanto una bassa carica virale HBV al trapianto minimizza il rischio di reinfezione da HBV/HDV. Per contro, i livelli di HDV RNA nel sangue non hanno rilevanza prognostica, essendo il rischio di trasmissione legato esclusivamente alla viremia HBV.
Lo studio di Samuel e coll. ha portato alla somministrazione continuativa di HBIg dopo il trapianto quale profilassi contro HDV, presumendo che HBIg si leghino ai virioni di HDV e ne prevengano la propagazione alle cellule epatiche. HBIg sono state inizialmente somministrate per via endovenosa, quindi per via intramuscolo e sottocutanea. In accordo alle raccomandazioni riportate dalla Associazione Europea di Trapianto di Fegato ed Intestino (ELITA) (5) il titolo anti HBs dovrebbe essere mantenuto intorno a 50-100 mUI/mL sia nei riceventi HBV che HBV/HDV.
Con l’introduzione sul mercato alla fine degli anni ‘90 degli analoghi nucleos(t)idici (NA) contro HBV, la combinazione di HBIg+NA è diventata la profilassi standard nei pazienti HBV, portando i tassi di recidiva post LT inferiori al 10% e riducendo la dose necessaria di HBIg sul lungo termine.
Di default, tale combinazione è stata impiegata anche per proteggere dalla reinfezione HDV e raccomandata dalle Società Scientifiche, (6) consentendo di ottenere ottimi risultati: in uno studio multicentrico europeo di 114 trapianti HDV effettuati tra il 2000 ed il 2016, Beckebaum e coll. hanno riportato una recidiva HBV del 3.5% a 70.9 mesi dal LT, in assenza di recidive HDV (7).
Prospettive di profilassi
La somministrazione a lungo termine di HBIg è sicuramente gravata da costi significativi ed è scomoda per il paziente. Pertanto, dopo l’introduzione di antivirali ad elevata barriera genetica quali entecavir e tenofovir, numerosi Centri Trapianto europei ed americani hanno adottato con successo la profilassi con NA in monoterapia.
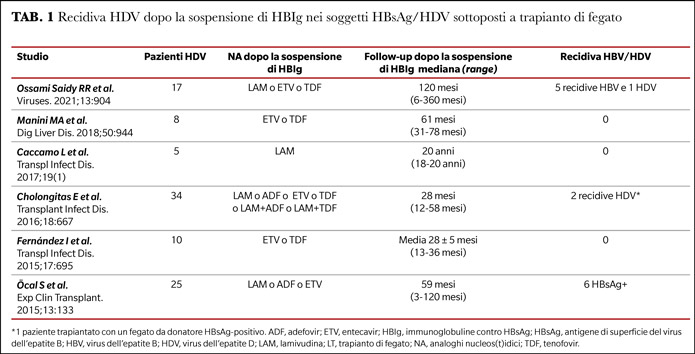
Tale strategia (NA in monoterapia), che pone al sicuro dalla replica di HBV ma non dall’espressione di HBsAg, può essere impiegata anche per HDV? Ad oggi nei pazienti HDV non sussiste evidenza che l’HBsAg da solo possa consentire la riattivazione di HDV, mentre l’esperienza clinica ha dimostrato che la recrudescenza dell’epatite D nel graft è necessariamente preceduta dalla riattivazione di HBV (8). Di conseguenza, l’uso di NA ad elevata barriera genetica, prevenendo la reinfezione da HBV, può costituire una profilassi efficace anche nei trapianti HDV. Tale conclusione è supportata dall’analisi dei trapianti HDV che hanno sospeso le HBIg proseguendo con NA in monoterapia: 34, 25 e 17 riceventi HDV arruolati rispettivamente da Cholongitas, Öcal e Ossami Saidy e coll. hanno ricevuto inizialmente la profilassi post trapianto con HBIg e NA, quindi hanno sospeso le HBIg e sono stati seguiti per 12-58 mesi (mediana 28), 3-120 mesi (mediana 59) e 6-360 mesi (mediana 120), rispettivamente. Due pazienti nella coorte di Cholongitas e coll. sono andati incontro a reinfezione HDV, tuttavia uno aveva ricevuto un organo da un donatore HBsAg positivo e la reinfezione era pertanto virtualmente inevitabile.
Nella serie di Öcal e coll., la HBs antigenemia è divenuta rilevabile in 6 pazienti, ma nessuno ha sviluppato la recidiva HDV. Nella serie di Ossami Saidy e coll., la recidiva HBV è avvenuta in 5 pazienti, di cui uno solo con reinfezione HDV. Nessuna reinfezione HDV si è verificata negli 8, 5 e 10 trapianti HDV, riportati rispettivamente da Manini, Caccamo, e Fernández e coll., che hanno sospeso le HBIg e sono stati seguiti per un follow-up mediano di 61 mesi, 20 anni e 28 mesi, rispettivamente (Tabella 1). Il tasso cumulativo di reinfezione HDV in tali studi è stato pertanto solamente del 2% (2/98).
Il futuro
Tra il 1988 ed il 2016, nel registro europeo dei trapianti sono riportati 7761 LT (9): 5822 (75%) dovuti ad infezione HBV e 1939 (25%) alla coinfezione HDV, con un rapporto HBV/HDV di 3 a 1. Negli ultimi 15 anni il numero di trapianti per HBV riportati nel registro si è dimezzato (3826) mentre quello per HDV/HBV si è ridotto soltanto di un quarto (1431), con un rapporto HBV/HDV di 2.7 a 1.
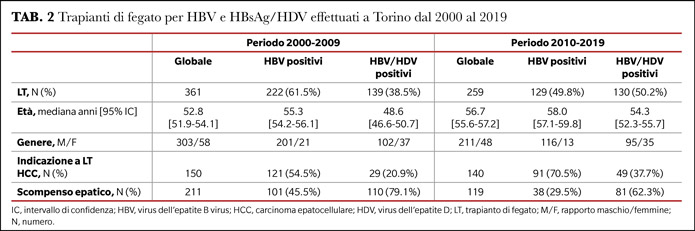
Nel centro trapianti di Torino di 361 e 259 portatori HBsAg trapiantati nelle decadi 2000-2009 e 2010-2019, 139 e 130, rispettivamente, erano coinfetti con HDV (38.5% HDV nel periodo 2000-2009 e 50.2% nel periodo 2010-2019).
A Torino, inoltre, nell’ultima decade il 62.3% dei pazienti HDV sono stati trapiantati per scompenso epatico e il 37.7% per HCC, mentre solo il 29.5% dei pazienti HBV è stato trapiantato per scompenso e il 70.5% per HCC, il cui sviluppo non può essere prevenuto dalle terapie antivirali (Tabella 2).
Questi numeri europei e torinesi sorprendono, considerato il calo di HDV in Europa. La spiegazione si può trovare nella persistenza di una coorte di pazienti con cirrosi HDV, infettatisi molte decadi fa, e che hanno ancora un impatto significativo sui programmi di trapianto.
Inoltre, sebbene l’epatite D stia scomparendo nelle popolazioni autoctone europee, il pool di HDV è alimentato dagli immigrati. Nel 2019 il 26.4% degli immigrati HBsAg positivi con epatopatia in Italia erano coinfetti con HDV.
Conclusioni
La profilassi standard con NA ad alta barriera genetica in associazione alle HBIg somministrate permanentemente post trapianto assicura un ottimo controllo virologico nel trapianto HDV. Tuttavia la sospensione delle HBIg pare attuabile altresì nel contesto dell’infezione da HDV, anche in considerazione delle nuove terapie contro HDV che sono attualmente in fase avanzata di studio o approvazione (10) come per bulevirtide. Sebbene nei Paesi industrializzati l’infezione da HDV stia scomparendo, la malattia persiste in una coorte storica di cirrotici che mantiene attiva la richiesta di LT.
- Rizzetto M. Hepatitis D virus. In: Wong RJ, Gish EG, eds. Clinical Epidemiology of Chronic Liver Disease. Cham, Switzerland: Springer. 2019;135-148.
- Rizzetto M, Hamid S, Negro F. The changing context of hepatitis D. J Hepatol. 2021;74:1200-1211.
- Rizzetto M, Macagno S, Chiaberge E, et al. Liver transplantation in hepatitis delta virus disease. Lancet. 1987;2:469-471.
- Samuel D, Muller R, Alexander G, et al. Liver transplantation in European patients with the hepatitis B surface antigen. N Engl J Med. 1993;329:1842-1847.
- Duvoux C, Belli LS, Fung J, et al. 2020 position statement and recommendations of the European Liver and Intestine Transplantation Association (ELITA): management of hepatitis B virus-related infection before and after liver transplantation. Aliment Pharmacol Ther. 2021;54:583-605.
- European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-398.
- Beckebaum S, Herzer K, Bauhofer A, et al. Recurrence of Hepatitis B Infection in Liver Transplant Patients Receiving Long-Term Hepatitis B Immunoglobulin Prophylaxis Ann Transplant. 2018;23:789-801.
- Martini S, Caccamo L, Rizzetto M. Are immunoglobulins against the HBsAg still needed in liver transplantation for hepatitis D? Hepatology. 2018;67:2475-2476.
- Adam R, Karam V, Cailliez V, et al. 2018 annual report of the European Liver Transplant Registry (ELTR) -50-year Evolution of Liver Transplantation. Transpl Int. 2018;31:1293-1317.
- Loureiro D, Castelnau C, Tout I, et al. New therapies for hepatitis delta virus infection. Liver Int. 2021;41:30-37.






