Il cancro è una delle principali cause di morte in più di 37 milioni di persone che vivono con HIV (PLWH) nel mondo. Numerosi studi hanno documentato un aumento di prevalenza di tumori non AIDS-defining (NADC) tra le persone con infezione da HIV-1 rispetto alla popolazione generale negli ultimi anni (1-3). Tale aumento di rischio può essere spiegato da una parte con l’immunosenescenza che in PLWH da oltre 30 anni può accompagnare l’invecchiamento e potenziarne le conseguenze negative sul sistema immunitario, dall’altra con la prolungata esposizione ad agenti cancerogeni legata all'aumentata sopravvivenza delle PLWH che ormai si può approssimare a quella della popolazione generale (4,5).
La popolazione con infezione da HIV è anche più suscettibile rispetto alla popolazione generale a frequenti coinfezioni con altri virus oncogeni (Epstein Barr Virus [EBV], Herpesvirus Umano 8 [HHV-8], Papilloma Virus Umano [HPV], Virus dell'Epatite B e C [HBV, HCV]) . Ciò comporta una maggiore probabilità cumulativa di sviluppo di cancro.
Impatto della terapia
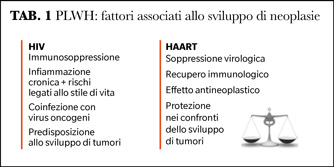 Quale è stato il ruolo della cART nel modificare l’incidenza delle neoplasie nelle PLWH? Sicuramente l’impatto sembra essere molto differente se si distinguono le neoplasie che definiscono AIDS (ADC) rispetto ai tumori che non definiscono AIDS (NADC). Per quanto riguarda le prime, la cART ha contribuito a un calo significativo dell'incidenza, con netto miglioramento della sopravvivenza (6). Tuttavia, il rischio di sviluppare tutte le ADC è ancora molto alto nelle PLWH con elevati livelli di immunodepressione (Tabella 1) (7). Per quanto invece riguarda i NADC, l’incidenza sembra in aumento rispetto a prima del 1996 e modelli matematici stimano che tale incidenza continui a crescere, sia per quanto riguarda i tumori virus-correlati che quelli non correlati a virus.
Quale è stato il ruolo della cART nel modificare l’incidenza delle neoplasie nelle PLWH? Sicuramente l’impatto sembra essere molto differente se si distinguono le neoplasie che definiscono AIDS (ADC) rispetto ai tumori che non definiscono AIDS (NADC). Per quanto riguarda le prime, la cART ha contribuito a un calo significativo dell'incidenza, con netto miglioramento della sopravvivenza (6). Tuttavia, il rischio di sviluppare tutte le ADC è ancora molto alto nelle PLWH con elevati livelli di immunodepressione (Tabella 1) (7). Per quanto invece riguarda i NADC, l’incidenza sembra in aumento rispetto a prima del 1996 e modelli matematici stimano che tale incidenza continui a crescere, sia per quanto riguarda i tumori virus-correlati che quelli non correlati a virus.
Per quanto riguarda la prognosi di neoplasie nelle PLWH tutti gli studi che in epoca di cART più moderna, a partire dalla diffusione degli INSTI, hanno tentato di definire un differente impatto di diverse strategie antiretrovirali (PI/b vs INSTI vs NNRTI) hanno sostanzialmente fallito, in quanto non sembrerebbe esserci alcun impatto differente, in termini sia di rischio di neoplasia che di evoluzione clinica tra i pazienti che hanno assunto diversi regimi antiretrovirali. In particolare è stato documentato che i regimi antiretrovirali basati su PI e NNRTI hanno un effetto protettivo simile sull'incidenza di ADC (8). Altri lavori hanno mostrato potenziali vantaggi di regimi a base di PI nella riduzione di incidenza di ADC rispetto ad altri regimi.
Alcuni piccoli studi hanno dimostrato una ridotta efficacia della cART a base di NNRTI nel prevenire le recidive di sarcoma di Kaposi (SK). Al contrario, gli NNRTI si sono dimostrati più potenti nel ridurre il rischio di linfoma non Hodgkin (NHL) (17). Per quanto riguarda gli INSTI, a differenza da quanto inizialmente suggerito, un recente studio di coorte di grandi dimensioni non ha trovato alcuna dimostrazione che gli INSTI siano associati a un aumento del rischio di cancro (9).
Per quanto riguarda i NADC, diversi studi di coorte di grandi dimensioni non hanno riportato alcuna differenza tra regimi basati su PI e regimi basati su NNRTI nella prevenzione di tutti i tipi di tumore, ad eccezione del cancro anale (10). è stata dimostrata in un singolo studio l'associazione di NNRTI con un aumento del rischio di NADC e di linfoma di Hodgkin e, al contrario, un altro studio ha dimostrato che l'incidenza complessiva di NADC è più alta nei soggetti che ricevono cART a base di PI. (8). Generalmente si può affermare che al momento non vi sono dimostrazioni che un particolare regime cART sia più o meno associato a un differente rischio di cancro.
Il paradigma dei linfomi
La sopravvivenza della popolazione che vive con HIV e che sviluppa neoplasie nell’arco della storia clinica non è sempre sovrapponibile a quella delle persone che sviluppano neoplasie simili nella popolazione generale e questo è dovuto, oltre che ad alcuni aspetti legati alle caratteristiche specifiche di alcuni tumori in corso di HIV, maggiormente aggressivi rispetto a quanto si manifesta nella popolazione generale, soprattutto al mancato accesso a trattamenti di prima scelta e di elezione da parte delle persone con HIV. Un aspetto paradigmatico riguarda i linfomi nelle PLWH: il trattamento dei linfomi da HIV si è evoluto nel corso del tempo, in linea con il controllo della replicazione dell'HIV e il recupero della funzione immunitaria grazie alla cART, consentendo una sopravvivenza globale (OS) di questi pazienti nettamente migliorata in epoca di cART, aumentando dal 13% nell'era pre-cART (1986-1995) al 70% nell'ultima era della cART (2006-2015) (11).
E nonostante ora gli esiti siano di fatto determinati sia dalle caratteristiche della malattia linfomatosa, (IPI score aggiustato per età), assenza di risposta completa (CR) alla terapia, che da fattori specifici dell'HIV come conta dei linfociti CD4, precedente diagnosi di AIDS, valori di viremia di HIV, le disparità in termini di sopravvivenza sembrano maggiormente legate al differente accesso a terapie innovative per la malattia ematologica, essendo le PLWH ancora escluse da trial clinici su nuovi farmaci.
Se si pensa, ad esempio, all’innovazione che immunoterapie antitumorali stanno portando nella terapia, implementare lo studio di tali meccanismi farmacologici nelle persone con HIV potrebbe indubbiamente portare ad un miglioramento della prognosi.
Immunoterapia
Nell'ultimo decennio, l'immunoterapia ha guadagnato maggiore attenzione nel trattamento dei tumori maligni e le strategie più utilizzate includono vaccini antitumorali, terapie con virus oncolitici, anticorpi monoclonali, checkpoint immunitari, citochine e terapie con cellule T (Tabella 2) (12).
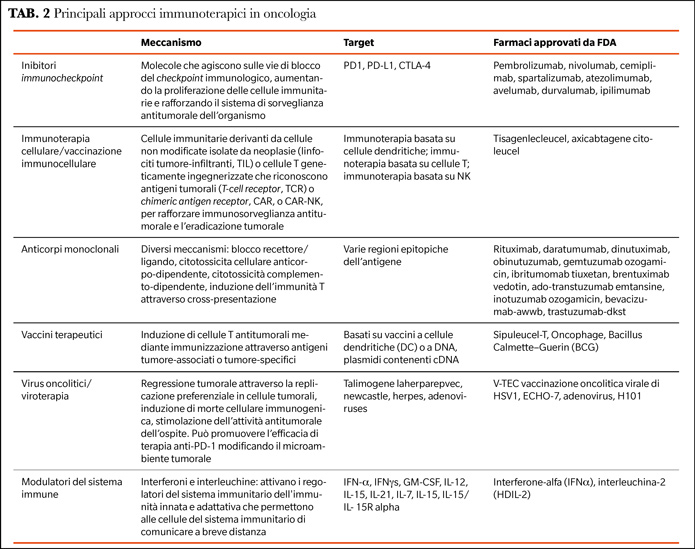
La FDA e l'EMA hanno approvato alcuni checkpoint blockers contro diversi tipi di cancro: Inibitori di PD-1 (programmed death protein-1) come pembrolizumab, nivolumab e cemiplimab, inibitori di PDL-1 (programmed death protein ligand 1) come atezolizumab, avelumab e durvalumab e anti-cytotoxic T-lymphocyte-associated protein-4 (CTLA-4) come ipilimumab (13). L'immunoterapia basata sul trattamento con anticorpi anti-PD-1/PD-L1 e anticorpi anti-CTLA-4 è oggi una pietra miliare dell'attuale trattamento del cancro e ha cambiato la prognosi dei tumori maligni avanzati, ottenendo remissioni a lungo termine senza precedenti.
Recenti studi di immunoviroterapia hanno riportato che i virus oncolitici come il talimogene laherparepvec, il newcastle, l'herpes e gli adenovirus possono essere utilizzati per il trattamento del cancro e diversi studi clinici sono in corso su questo tema. Nel 2015, la FDA ha approvato per la prima volta l'uso di V-TEC, una vaccinazione virale oncolitica dell'herpes simplex 1 (HSV1), per il trattamento del melanoma. Uno dei vantaggi della terapia virale oncolitica è la stimolazione dell'immunogenicità e dell'antigenicità dei tumori, che li rende più sensibili e più compatibili con regimi di combinazione con altre immunoterapie (12).
Molti studi sostengono che le combinazioni di immunoterapia virale oncolitica e di blocchi del checkpoint come PD-1 sono superiori alle singole terapie (12,13). I farmaci immunoterapici sono promettenti per trattare separatamente sia i tumori che l'infezione da HIV. L'applicazione dell'immunoterapia ad un paziente con condizioni coesistenti di HIV/AIDS e tumore maligno è un importante progresso. Finora, due studi prospettici hanno analizzato la sicurezza e l'attività degli anticorpi anti-PD-1/PD-L1 in persone con infezione da HIV-1 e cancro (14), e sono state confermate diverse serie retrospettive e di casi (15).
Considerando i nuovi farmaci immunoterapici sviluppati contro l'infezione da HIV/AIDS e i tumori, sono necessarie ulteriori ricerche per elaborare terapie di combinazione più efficaci per i pazienti oncologici HIV+.
L’introduzione di PLWH nello sviluppo di nuovi farmaci oncologici al pari delle altre persone incluse nei trial clinici consentirà di ottenere risultati utilizzabili su larga scala in questo gruppo di pazienti, superando gli ostacoli regolatori che al momento attuale limitano loro l’accesso alle cure più efficaci e innovative.
- Wang CJ, Silverberg MJ, D.I. Abrams DI et al. Non-AIDS-Defining Malignancies in the HIV-Infected Population, Curr. Infect. Dis. Rep. 2014; 16 (6): 406.
- Chiu CG, Smith D, Salters KA et al. Overview of cancer incidence and mortality among people living with HIV/AIDS in British Columbia, Canada: Implications for HAART use and NADM development, BMC Cancer 2017; 17:270.
- Engels EA. Non-AIDS-defining malignancies in HIV-infected persons: etiologic puzzles, epidemiologic perils, prevention opportunities, AIDS (London, England) 2009; 23 (8): 875–885.
- Suneja G, Shiels MS, Angulo R, et al., Cancer Treatment Disparities in HIV-Infected Individuals in the United States, J. Clin. Oncol. 2014; 32 (22):2344–2 350.
- Yarchoan R, Uldrick TS. HIV-Associated Cancers and Related Diseases, N. Engl. J. Med. 2018; 378 (11): 1029–1041.
- Franceschi S, Maso LD, Rickenbach M, et al. Kaposi sarcoma incidence in the Swiss HIV cohort Study before and after highly active antiretroviral therapy. Br J Cancer 2008;99:800–4.
- Guiguet M, Boué F, Cadranel J, et al. Clinical epidemiology group of the FHDH-ANRS CO4 cohort. Effect of immunodeficiency, HIV viral load, and antiretroviral therapy on the risk of individual malignancies (FHDH-ANRS CO4): a prospective cohort study. Lancet Oncol 2009;10: 1152–9.
- Bruyand M, Ryom L, Shepherd L, et al. Cancer risk and use of Protease Inhibitor or nonnucleoside reverse transcriptase Inhibitor– based combination antiretroviral therapy. J Acquir Immune Defic Syndr 2015;68: 568–77.
- Cozzi-Lepri A, Zangerle R, Machala L, et al. Incidence of cancer and overall risk of mortality in individuals treated with raltegravir-based and non-raltegravir-based combination antiretroviral therapy regimens. HIV Med 2018;19:102–17.
- Crum-Cianflone NF, Hullsiek KH, Marconi V, et al. The impact of nelfinavir exposure on cancer development among a large cohort of HIV infected patients. J Acquir Immune Defic Syndr 2009;51:305–9.
- Ramaswami R, Chia G, Dalla Pria A, et al. Evolution of HIV-associated lymphoma over 3 decades. J Acquir Immune Defic Syndr. 2016;72(2):177-183.
- Taefehshokr N, Baradaran B, Baghbanzadeh A, Taefehshokr S, Promising approaches in cancer immunotherapy, Immunobiology 2020; 225 (2): 151875.
- Makuku R, Khalili N, Razi S, et al. Current and Future Perspectives of PD-1/PDL-1 Blockade in Cancer Immunotherapy, J. Immunol. Res. 2021; 2021:6661406.
- Kadia TM, Release the hounds: virotherapy with immunotherapy, Blood 2016; 127 (11): 1381–1383.
- Uldrick TS, Gonçalves PH, Abdul-Hay M, et al., Assessment of the Safety of Pembrolizumab in Patients With HIV and Advanced Cancer-A Phase 1 Study, JAMA Oncol.2019; 5 (9) ;1332–1339.






