L’idea di una molecola di RNA messaggero (mRNA) da utilizzare come ‘farmaco molecolare’ nasce alle fine degli anni ‘80, quando Robert Malone et al. dimostrarono che molecole di mRNA esogene potevano essere usate per indurre l’espressione di proteine in una cellula ospite (1).
Da quel momento, la tecnologia dell’mRNA come strategia vaccinale ha fatto enormi passi avanti, superando iniziali ostacoli, quali la relativa instabilità, la mancanza di un efficace sistema di delivery, l’attivazione dell’immunità innata e la difficoltà di una sintesi su larga scala. Tutto ciò si è tradotto in una tecnologia dotata di ampia versatilità e a basso costo, con trial vaccinali in corso sia contro vari patogeni che verso alcuni tipi di cancro (2). Ma soprattutto, grazie allo sviluppo del sistema di veicolazione tramite nanoparticelle lipidiche (LNP), i vaccini a mRNA hanno portato ad una pietra miliare del progresso scientifico, rappresentata dal successo nel controllo della mortalità, e in parte della diffusione, di SARS-CoV-2.
L’ondata di successi della tecnologia a mRNA ha rinvigorito la speranza in un vaccino efficace contro il virus dell’immunodeficienza umana di tipo 1 (HIV-1), verso cui ad oggi non esiste né un vaccino né una cura. Nonostante l’efficacia della terapia antiretrovirale nel trattamento e nella prevenzione delle infezioni, la necessità di un vaccino e una cura per HIV-1 è di fondamentale importanza, a causa del persistente stigma, dei possibili effetti collaterali e del limitato accesso alla ART a livello globale.
Le differenze tra SARS-CoV-2 e HIV-1
Ma quali sono le cause che hanno portato a un successo notevole del vaccino contro SARS-CoV-2 in così poco tempo, mentre quello contro HIV-1 risulta così sfuggevole? Per prevenire forme severe di COVID-19 è sufficiente indurre alti titoli anticorpali. Contrariamente, il diverso ciclo replicativo di HIV-1 fa sì che il reservoir (provirus integrati) si formi nelle cellule ospiti appena dopo 72 ore dall’infezione. Ne consegue che un ideale vaccino anti-HIV-1 dovrebbe stimolare sia la risposta umorale che quella cellulare. In questo modo, gli anticorpi neutralizzanti fornirebbero il primo strato di difesa, e nel caso in cui qualche virione riuscisse a eluderla, i linfociti T CD8+ citotossici eliminerebbero le cellule infette (3).
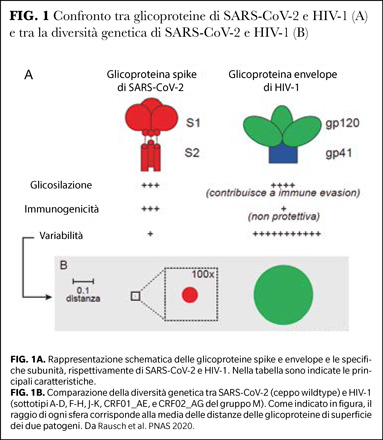 Da un punto di vista strutturale, il principale target degli anticorpi neutralizzanti anti-SARS-CoV-2 è uno specifico dominio (come il receptor binding domain) della glicoproteina spike, mentre per HIV-1 è la glicoproteina dell'envelope (Figura 1).
Da un punto di vista strutturale, il principale target degli anticorpi neutralizzanti anti-SARS-CoV-2 è uno specifico dominio (come il receptor binding domain) della glicoproteina spike, mentre per HIV-1 è la glicoproteina dell'envelope (Figura 1).
L’alta glicosilazione di questa proteina preclude il riconoscimento di epitopi chiave per la neutralizzazione, favorendo ulteriormente l’evasione dal sistema immunitario. Infine, la scarsa fedeltà e l’elevata attività di ricombinazione della retrotrascrittasi di HIV-1 generano continui mutanti virali, risultando in una diversità che rende il controllo da parte delle difese dell’ospite, così come il disegno di un vaccino, una sfida formidabile (4).
Ad oggi, solamente il trial thailandese RV144, basato su un vettore virale, ha dimostrato una parziale efficacia (31% di prevenzione delle nuove infezioni) (5). Ispirati allo studio thailandese, si sono susseguiti diversi trial, con risultati deludenti. Tra i più recenti ci sono i trial HVTN 702-Uhambo e 705-Imbokodo svolti in Africa, conclusi prematuramente poiché nessuno dei due è riuscito a riprodurre lo studio RV144 (4, 6). Le motivazioni per tale insuccesso sembrano dovute alla differenza del sottotipo circolante nelle due popolazioni, alle diverse caratteristiche genetiche dei partecipanti e alla diversa incidenza del rischio di infezione, molto più bassa nella popolazione thailandese (4).
Correlati di protezione
Una più recente strategia contro HIV-1 è basata sull’induzione di anticorpi ad ampia neutralizzazione (bnAb). Solitamente i bnAb vengono trovati in meno del 10% circa degli individui con infezione cronica non in terapia, caratterizzati da elevata viremia. Ciò che li rende interessanti è la capacità di neutralizzare con elevata potenza non solo virus autologhi, ma anche i ceppi eterologhi. In studi su macachi, questi anticorpi hanno dimostrato un’efficace prevenzione della trasmissione di HIV-1 (7), ed il loro potenziale “effetto vaccinale” li rende allettanti strumenti terapeutici per il controllo del reservoir.
Tuttavia, l’uso dei bnAb incontra alcune problematiche da risolvere: i) una struttura non canonica che ne limita la generazione, ii) l’alto rischio di sviluppare anticorpi anti-bnAb, iii) l’estensiva maturazione (tramite ipermutazione somatica) nei centri germinativi, e iv) la necessità di combinare molteplici bnAb per fare fronte alla diversità di HIV-1 (8). Nel trial HVTN 703, dove i soggetti hanno avuto molteplici somministrazioni di un singolo bnAb (VRC01), non si è osservata nessuna efficacia nel prevenire l’infezione da HIV-1 (4).
Anche l’induzione di una risposta citotossica da parte dei linfociti T CD8+ dovrà risolvere alcune problematiche, prima tra tutte quella di coprire l’enorme diversità virale (8). Dagli studi in vitro è emerso che epitopi di HIV-1 con grande conservazione in gag, pol e nef offrono una copertura ottimale contro una grande varietà di ceppi.
Nonostante l’evidenza di protezione in modelli animali, in nessuno dei recenti trial clinici (es. gli studi HVTN 502, 503 e 505), è stata riscontrata un’efficacia adeguata nel ridurre l’infezione (4), supportando sempre di più l’ipotesi che le risposte date da cellule B (e quindi CD4) e CD8 siano entrambe necessarie.
Vaccini a mRNA contro HIV-1
Quale ruolo può avere quindi la piattaforma vaccinale basata su mRNA nella risoluzione di queste problematiche per arrivare ad un vaccino efficace contro HIV-1?
Ad oggi, la produzione di mRNA risulta veloce e caratterizzata da un’alta resa in termini di produzione e purezza. Inoltre, gli mRNA permettono la produzione degli immunogeni direttamente in vivo, fatto che ne assicura un corretto ripiegamento e glicosilazione. Questo potrebbe essere di fondamentale importanza per la stimolazione e la produzione dei bnAb, insieme all’evidenza che questo tipo di vaccino sembra indurre potenti risposte anticorpali tramite l’attivazione dei centri germinativi. Infine, i vaccini a mRNA sembrano in grado di attivare contemporaneamente sia la risposta umorale che cellulare. Infatti, in seguito alla somministrazione del vaccino BNT162b2 contro SARS-CoV-2, è stata osservata anche una risposta cellulare T CD8+ citotossica, anche se ulteriori studi saranno necessari per definire questo aspetto, visto che una minor risposta dei CD8 è stata osservata in seguito al vaccino mRNA-1273 (8).
Attualmente, sono in corso due trial clinici basati su un vaccino a mRNA anti-HIV-1. Entrambi, ad oggi in fase 1, prevedono una somministrazione sequenziale di immunogeni così da ricapitolare la formazione dei bnAb. Il trial IAVI G002, lanciato nel gennaio 2022, testerà il vaccino mRNA-1644 con l’ipotesi che sia in grado di ottenere un’efficiente selezione di cloni di cellule B in grado di produrre bnAb (9). Il secondo, il trial HVTN 302, testerà invece il vaccino mRNA-1574, andando a produrre molecole trimeriche dell’envelope (10).
Verso nuovi approcci di terapia genica
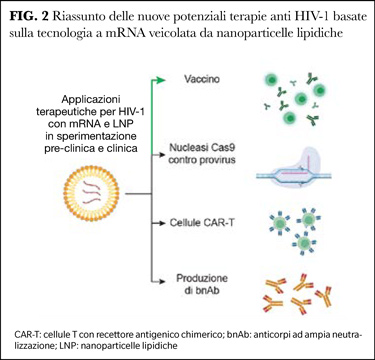 La tecnologia a mRNA non si limita a offrire promettenti risultati per i vaccini, ma offre anche nuovi approcci di terapia genica mirati al controllo dei reservoir (Figura 2).
La tecnologia a mRNA non si limita a offrire promettenti risultati per i vaccini, ma offre anche nuovi approcci di terapia genica mirati al controllo dei reservoir (Figura 2).
Attualmente, le ~109 cellule dei pazienti vengono raccolte tramite aferesi, ingegnerizzate ex vivo con vettori virali, espanse e re-infuse nel paziente, una procedura che risulta complessa e con costi proibitivi. Ma il sistema di delivery dell’mRNA tramite LNP ha reso possibile l’introduzione in vivo di “forbici molecolari” CRISPR-Cas9 nei linfociti T CD4+, per riconoscere e tagliare sequenze provirali di HIV-1, rendendole difettive (11). Inoltre, lo stesso sistema potrebbe essere usato per indurre la produzione di un cocktail di bnAb, o generare cellule CAR-T (cellule T CD8+ e CD4+ con recettori antigenici chimerici, capaci di riconoscere ed eliminare cellule infette da HIV-1), come recentemente mostrato da dati preliminari del gruppo di Weissmann, uno dei pionieri della tecnologia a mRNA.
In conclusione, nonostante tre decadi di sforzi scientifici, il percorso per arrivare ad un vaccino o ad una terapia che permetta il controllo di HIV-1 in assenza di ART rimane ancora lungo e difficile. Tuttavia, le caratteristiche e i recenti successi della tecnologia a mRNA fanno sperare che questo obiettivo sia finalmente raggiungibile.
- Malone RW, Felgner PL, Verma IM. Cationic liposome-mediated RNA transfection. Proc Natl Acad Sci USA. 1989; 86(16):6077-81.
- Pardi N, Hogan M, Porter F, et al. mRNA vaccines - a new era in vaccinology. Nat Rev Drug Discov. 2018; 17, 261-279.
- Haynes BF. SARS-CoV-2 and HIV-1 - a tale of two vaccines. Nat Rev Immunol. 2021; 21(9):543-544.
- Kim J, Vasan S, Kim JH, et al. Current approaches to HIV vaccine development: a narrative review. J Int AIDS Soc. 2021; 24 7(7):e25793.
- Robb ML, Rerks-Ngarm S, Nitayaphan S, et al. Risk behaviour and time as covariates for efficacy of the HIV vaccine regimen ALVAC-HIV (vCP1521) and AIDSVAX B/E: a post-hoc analysis of the Thai phase 3 efficacy trial RV 144. Lancet Infect Dis. 2012; 12:531-7.
- NIH. HIV Vaccine Candidate Does Not Sufficiently Protect Women Against HIV Infection. https://https://www.nih.gov/news-events/news-releases/hiv-vaccine-candidate-does-not-sufficiently-protect-women-against-hiv-infection.
- Williams WB, Wiehe K, Saunders KO, et al. Strategies for induction of HIV-1 envelope-reactive broadly neutralizing antibodies. J Int AIDS Soc. 2021; 24 7(7):e25831.
- Mu Z, Haynes BF, Cain DW. HIV mRNA Vaccines-Progress and Future Paths. Vaccines (Basel). 2021; 9(2):134.
- IAVI. IAVI and Moderna launch trial of HIV vaccine antigens delivered through mRNA technology. https://www.iavi.org/news-resources/press-releases/2022/iavi-and-moderna-launch-trial-of-mrna-hiv-vaccine-antigens.
- NIH. NIH launches clinical trial of three mRNA HIV vaccines. https://www.nih.gov/news-events/news-releases/nih-launches-clinical-trial-three-mrna-hiv-vaccines.
- Deeks SG, Archin N, Cannon P, et al. Research priorities for an HIV cure: International AIDS Society Global Scientific Strategy 2021. Nat Med. 2021; 27(12):2085-2098.






