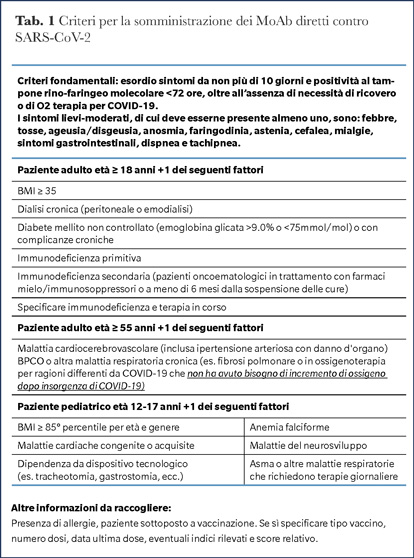
 Gli anticorpi monoclonali (MoAb) rappresentano la classe di farmaci che negli ultimi 20 anni ha conosciuto la maggiore espansione e il cui impiego ha profondamente cambiato la gestione delle patologie oncologiche, infiammatorie e degenerative. Ciononostante solo per tre patologie microbiche l’uso di MoAb è approvato da alcuni anni (colite da Clostridioides, antrace, polmonite da virus respiratorio sinciziale), utilizzando uno scaffold appartenente alla classe delle immunoglobuline IgG1 (1). Più recentemente risultati incoraggianti sono stati ottenuti nella terapia della malattia da Ebola virus. Alla data odierna non sono disponibili trattamenti eziologici efficaci per la malattia da SARS-CoV-2. Anche per questo motivo, come è stato per remdesivir e per i numerosi vaccini disponibili, un certo numero di anticorpi monoclonali anti-SARS-CoV-2 ha ottenuto l’autorizzazione per l’uso in emergenza (EUA), prima dagli enti regolatori sovranazionali e subito dopo da quelli nazionali, riducendo notevolmente i tempi normalmente necessari per la registrazione di un nuovo medicinale. Le indicazioni attuali di Regione Lombardia per l’impiego di questi monoclonali sono riportate in Tabella 1.
Gli anticorpi monoclonali (MoAb) rappresentano la classe di farmaci che negli ultimi 20 anni ha conosciuto la maggiore espansione e il cui impiego ha profondamente cambiato la gestione delle patologie oncologiche, infiammatorie e degenerative. Ciononostante solo per tre patologie microbiche l’uso di MoAb è approvato da alcuni anni (colite da Clostridioides, antrace, polmonite da virus respiratorio sinciziale), utilizzando uno scaffold appartenente alla classe delle immunoglobuline IgG1 (1). Più recentemente risultati incoraggianti sono stati ottenuti nella terapia della malattia da Ebola virus. Alla data odierna non sono disponibili trattamenti eziologici efficaci per la malattia da SARS-CoV-2. Anche per questo motivo, come è stato per remdesivir e per i numerosi vaccini disponibili, un certo numero di anticorpi monoclonali anti-SARS-CoV-2 ha ottenuto l’autorizzazione per l’uso in emergenza (EUA), prima dagli enti regolatori sovranazionali e subito dopo da quelli nazionali, riducendo notevolmente i tempi normalmente necessari per la registrazione di un nuovo medicinale. Le indicazioni attuali di Regione Lombardia per l’impiego di questi monoclonali sono riportate in Tabella 1.
La prima registrazione di MoAb specifici per SARS-CoV-2 ha riguardato bamlanivimab (LY-CoV555) ed etesevimab (LY-CoV016). È stato dapprima valutato bamlanivimab come terapia singola per i pazienti ambulatoriali. Il trial di fase 2 (BLAZE-1) ha indagato una singola somministrazione di bamlanivimab in 3 dosaggi differenti (700, 2800 o 7000 mg EV) versus placebo in 452 pazienti con un’infezione da SARS-CoV-2 lieve o moderata. Gli outcome sono stati virologici e clinici, in dettaglio l’endpoint primario è stato il delta della carica virale di SARS-CoV-2 dalla somministrazione (giorno 1) al giorno 11. I risultati del trial sono stati favorevoli ma non straordinari: la riduzione della carica virale, misurata in logRNA, è stata di –3.47 nel gruppo placebo versus –3.70 nel gruppo trattato con bamlanivimab, indipendentemente dalla dose. I soggetti che hanno ricevuto la dose di 2800 mg hanno mostrato una differenza di –0.53 rispetto al placebo e questo delta è risultato significativo (p=0.02). I pazienti trattati con bamlanivimab hanno mostrato, nei giorni 2-6, sintomi leggermente meno severi rispetto a chi aveva ricevuto placebo, mentre per quanto riguarda il principale outcome secondario, l’ospedalizzazione o l’accesso in pronto soccorso al giorno 29, l’incidenza nel gruppo placebo è stata del 6.3% versus il 1.6% nel gruppo trattato con bamlanivimab (5 pazienti totali, con un gradiente dalla dose più alta alla dose più bassa). L’analisi post-hoc ha evidenziato che tra i pazienti con più di 65 anni di età o un BMI ≥35 chi aveva ricevuto bamlanivimab il tasso di ospedalizzazione era il 4% versus il 15% in chi aveva ricevuto placebo (2).
Gottlieb e colleghi hanno esteso la descrizione del trial BLAZE-1 alla terapia combinata bamlanivimab 2800 mg + etesevimab 2800 mg (combo), condotta in parallelo ai 3 gruppi trattati con bamlanivimab ed al gruppo che riceveva placebo. In questa analisi, per quanto riguarda l’endpoint primario virologico, il gruppo combo si mostrava significativamente diverso dal gruppo placebo. I risultati derivati da questa seconda analisi erano diversi da quelli descritti nel precedente lavoro, in particolare emergeva una differenza significativa del gruppo combo ai giorni 7 e 11 rispetto agli altri gruppi di pazienti. La differenza nei risultati è da imputare alla chiusura del database in maniera definitiva, che ha causato la perdita della significatività virologica nel gruppo che aveva ricevuto bamlanivimab 2800 mg rispetto a placebo. L’analisi estesa del trial BLAZE-1 ha anche mostrato una differenza nell’endpoint secondario delle ospedalizzazioni ed accessi al pronto soccorso: 5.8% nel gruppo placebo, 1% 700 mg bamlanivimab, 1.9% 2800 mg bamlanivimab, 2% 7000 mg bamlanivimab e 0.9% nel gruppo combo (3). Questi risultati non hanno avuto la conferma nel trial ACTIV-3/TICO nei pazienti ospedalizzati, trattati con bamlanivimab. In questo caso i pazienti, che non dovevano presentare deficit d’organo, ricevevano bamlanivimab 7000 mg versus placebo accompagnato se ritenuto opportuno dal medico da corticosteroidi, remdesivir e supplementazione di ossigeno. Questo trial è stato interrotto dal DSMB per futilità, es. l’intervento sperimentale non portava alcun vantaggio rispetto al controllo. La sperimentazione ha pertanto concluso che bamlanivimab insieme a remdesivir non ha portato ad una maggiore efficacia, misurata con la guarigione durante il follow-up di 90 giorni. I dati dimostrano che il trattamento con MoAb deve essere instaurato molto precocemente ed in assenza di sintomi, pertanto non è raccomandato nei pazienti che al contrario hanno necessità di ospedalizzazione (4).
È in corso un altro trial di fase 2, BLAZE-4, in cui bamlanivimab potrebbe iniziare una seconda vita: nello studio viene testata l’associazione di bamlanivimab + VIR-7831 (GSK4182136), un altro MoAb che si lega a una diversa regione della proteina spike rispetto a bamlanivimab e che era stato inizialmente identificato legarsi alla proteina spike di SARS-CoV-1.
VIR-7831 (GSK4182136) è un MoAb dotato di una doppia azione: blocco dell’entrata virale nelle cellule suscettibili ed eliminazione delle cellule già infette. Questo MoAb è stato testato in un trial di fase 3 (COMET-ICE) come monoterapia per il trattamento precoce di pazienti adulti ad alto rischio di ospedalizzazione. Il DSMB di valutazione del trial ne ha raccomandato l’interruzione perché il MoAb era nettamente più efficace del placebo nel ridurre (-85%, p=0.002) sia i ricoveri che i decessi. Le ditte che stanno sviluppando VIR-7831 (GSK4182136) hanno intenzione di presentare domanda autorizzativa all’FDA per l’uso emergenziale di questo MoAb. Grazie al legame del MoAb con un epitopo altamente conservato della proteina spike, studi in vitro ne hanno evidenziato l’efficacia contro le varianti inglese, sudafricana e brasiliana. È in corso uno studio di fase 2 (COMET-PEAK) allo scopo di valutare la sicurezza e l’efficacia virologica di VIR-7831 (GSK4182136) somministrato per via im versus ev in soggetti con infezione lieve-moderata da SARS-CoV-2 per valutarne la farmacocinetica.
 Il secondo cocktail di monoclonali (REGN-COV2) che ha ottenuto l’EUA è la combinazione di REGN-COV10933 (casirivimab) e REGN-COV10987 (imdevimab). Entrambi sono anticorpi IgG1 umani che si legano a due siti differenti del receptor binding domain (RBD) della proteina spike (S) di SARS-CoV-2 e lo neutralizzano impedendone l’ingresso nella cellula ospite. Il trial registrativo è stato condotto su pazienti non ospedalizzati, che non necessitavano di supporto respiratorio e con esordio dei sintomi entro la precedente settimana. Al momento della somministrazione (t0), il 45% dei pazienti randomizzati aveva già sviluppato una risposta anticorpale anti-SARS-CoV-2. Dopo 7 giorni dalla somministrazione si è osservata, nei pazienti sieronegativi (quelli con infezione più recente) una riduzione di 0.56 log copie/ml del viral load su tampone nasofaringeo. La riduzione è risultata significativamente superiore nei pazienti con viral load più elevato al t0 (Figura 1).
Il secondo cocktail di monoclonali (REGN-COV2) che ha ottenuto l’EUA è la combinazione di REGN-COV10933 (casirivimab) e REGN-COV10987 (imdevimab). Entrambi sono anticorpi IgG1 umani che si legano a due siti differenti del receptor binding domain (RBD) della proteina spike (S) di SARS-CoV-2 e lo neutralizzano impedendone l’ingresso nella cellula ospite. Il trial registrativo è stato condotto su pazienti non ospedalizzati, che non necessitavano di supporto respiratorio e con esordio dei sintomi entro la precedente settimana. Al momento della somministrazione (t0), il 45% dei pazienti randomizzati aveva già sviluppato una risposta anticorpale anti-SARS-CoV-2. Dopo 7 giorni dalla somministrazione si è osservata, nei pazienti sieronegativi (quelli con infezione più recente) una riduzione di 0.56 log copie/ml del viral load su tampone nasofaringeo. La riduzione è risultata significativamente superiore nei pazienti con viral load più elevato al t0 (Figura 1).
Nel mese successivo alla somministrazione, complessivamente, i pazienti trattati hanno richiesto cure mediche nel 3% dei casi, contro il 6% del braccio placebo. Tra i pazienti sieronegativi al t0, la necessità di cure mediche a 30 giorni, è stata del 59% inferiore nei trattati rispetto al braccio placebo (5).
I risultati di un RCT di prossima pubblicazione, condotto su una casistica molto ampia trattata con REGN-COV2, non confermano le differenze precedentemente descritte nella riduzione del viral load e dell’outcome clinico in relazione alla presenza o meno di anticorpi anti-SARS-CoV-2 (6). Gli studi nel modello animale, sia nell’hamster siriano - che sviluppa una forma grave di malattia da SARS-CoV-2, con grave insufficienza respiratoria - che nel Macacus rhesus - nel quale la malattia è più lieve e autolimitantesi - suggeriscono comunque come l’efficacia di REGN-COV2 è massima quando il trattamento viene effettuato molto precocemente dopo l’infezione oppure come profilassi pre-esposizione.
La somministrazione di REGN-COV2 72 ore prima, oppure 24 ore dopo l’inoculo del virus per via nasale o intratracheale, determina una rapida riduzione del viral load nelle alte (tampone nasofaringeo) e nelle basse vie respiratorie (liquido di broncolavaggio) rispetto al placebo. Analogamente il reperto autoptico di danno polmonare da COVID-19 è ridotto negli animali trattati preventivamente o molto precocemente rispetto a quelli del braccio placebo. La somministrazione di REGN-COV2 non si è mai associata ad aumento del viral load o a fenomeni di esacerbazione della malattia anticorpo-mediati (7).
Nell’uomo è stata testata la validità dell’approccio con gli MoAb nella prevenzione dell’infezione da SARS-CoV-2. Questa strategia è perfettamente sensata perché questi anticorpi neutralizzanti agiscono all’esterno della cellula suscettibile ed hanno la massima azione nelle primissime fasi dell’incontro tra virus e cellula ospite. Il trial BLAZE-2 ha indagato la strategia di prevenzione nelle nursing homes e assisted living facilities negli Stati Uniti. Gli ospiti erano trattati con bamlanivimab, bamlanivimab + etesevimab o placebo. Il trial è in corso ed al momento sono disponibili i risultati di bamlanivimab versus placebo: dopo che tutti i partecipanti hanno raggiunto la settimana 8 è stato possibile rilevare una frequenza inferiore di infezione sintomatica negli ospiti che hanno ricevuto bamlanivimab (odds ratio 0.43, p=0.00021). Inoltre, nel gruppo dei residenti nelle nursing homes è apparsa una frequenza significativamente ridotta nei soggetti trattati con bamlanivimab versus placebo (odds ratio 0.20, p=0.00026), il che indica che coloro che hanno ricevuto bamlanivimab in questo studio hanno l’80% di riduzione del rischio di contrarre l’infezione rispetto a coloro che ricevevano placebo (8).
Un altro aspetto importante e complesso della terapia con MoAb anti-COVID-19 è quello relativo alle varianti virali. La proteina spike di SARS-CoV-2 è il target sia delle terapie che si basano sull’uso di anticorpi (monoclonali, immunoglobuline, plasma da pazienti guariti), sia dei vaccini, ma anche della risposta immunitaria neutralizzante.
La pressione selettiva esercitata da ogni intervento terapeutico esterno in questo caso coincide con quella della risposta immunitaria naturale all’infezione: entrambe possono favorire la selezione di virus mutati. La modalità di emergenza delle varianti virali è verosimilmente molteplice: sia la persistenza del virus nei soggetti con risposta immunitaria inadeguata, che il passaggio in altre specie animali e quindi il ritorno nella specie umana, potrebbero favorirla. La coformulazione di più monoclonali è finalizzata a limitare la possibilità di escape da parte di ceppi resistenti. Il 16 aprile scorso, l’FDA ha annullato l’autorizzazione di bamlanivimab in monoterapia a causa dell’emergenza di varianti virali resistenti.
 Le mutazioni che si verificano nelle posizioni dalla 438 alla 506 della sequenza che codifica la proteina S, sono quelle che hanno una rilevanza maggiore in termini di potenziale escape alla risposta immunitaria. Nelle varianti virali ad oggi isolate sono state identificate un certo numero di mutazioni che potenzialmente conferiscono resistenza totale o parziale ai MoAb attualmente disponibili (in Tabella 2 sono elencate le mutazioni identificate con maggiore frequenza).
Le mutazioni che si verificano nelle posizioni dalla 438 alla 506 della sequenza che codifica la proteina S, sono quelle che hanno una rilevanza maggiore in termini di potenziale escape alla risposta immunitaria. Nelle varianti virali ad oggi isolate sono state identificate un certo numero di mutazioni che potenzialmente conferiscono resistenza totale o parziale ai MoAb attualmente disponibili (in Tabella 2 sono elencate le mutazioni identificate con maggiore frequenza).
Tra le varianti circolanti che destano maggiore preoccupazione dal punto di vista epidemiologico: la B.1.351 (Sud Africa) presenta resistenza parziale a casirivimab ed elevata a bamlanivimab e etesevimab; la B.1.1.28/P1 (Brasile) presenta parziale resistenza a casirivimab e etesevimab e resistenza elevata a bamlanivimab (9).
Bibliografia
- Irani V, Guy AJ, Andrei D, et al.. Molecular properties of human IgG subclasses and their implications for designing therapeutic monoclonal antibodies against infectious diseases. Mol Immunol. 2015;67:171-182.
- Chen P, Nirula A, Heller B et al. SARS-CoV-2 Neutralizing antibody LY-CoV555 in outpatients with Covid-19. N Engl J Med. 2021;384(3):229-237.
- Gottlieb RL, Nirula A, Chen P et al., Effect of bamlanivimab as monotherapy or in combination with etesevimab on viral load in patients with mild to moderate COVID-19: a randomized clinical trial. JAMA. 2021;325(7):632-644.
- ACTIV-3/TICO LY-CoV555 Study Group. A neutralizing monoclonal antibody for hospitalized patients with COVID-19. N Engl J Med.2021;384(10):905-914.
- Weinreich DM, Sivapalasingam S, Norton T, et al. REGN-CoV2, a neutralizing antibody cocktail, in outpatients with Covid-19. N Engl J Med 2021; 384 (2): 238-251.
- Weinreich DM, Sivapalasingam S, Norton T et al: REGEN-COV antibody cocktail clinical outcomes study in Covid-19 outpatients. Submitted/in press.
- Baum A, Ajithdoss D, Copin R, et al. REGN-COV2 antibodies prevent and treat SARS-CoV-2 infection in rhesus macaques and hamsters. Science 2020; 370: 1110-1115.
- NCT044979897; clinicaltrials.gov
- Focosi D, Maggi F. Neutralising antibody escape of SARS-CoV-2 spike protein: risk assessment for antibody-based Covid-19 therapeutics and vaccine. Rev Med Virol 2021; 1-21.






