L’incremento ponderale in corso di terapia antiretrovirale è un argomento che sta focalizzando negli ultimi anni l’attenzione di molti clinici e ricercatori. Nonostante l’ampia gamma di studi compiuti su molti aspetti di questo fenomeno, non è ancora completamente chiara la sua eziopatogenesi che, per altro, con ogni probabilità è di origine multifattoriale. Qui di seguito analizzeremo i principali meccanismi che potrebbero essere alla base di questa che è, attualmente, considerata una ulteriore comorbilità in corso di infezione da HIV.
Ritorno alla salute
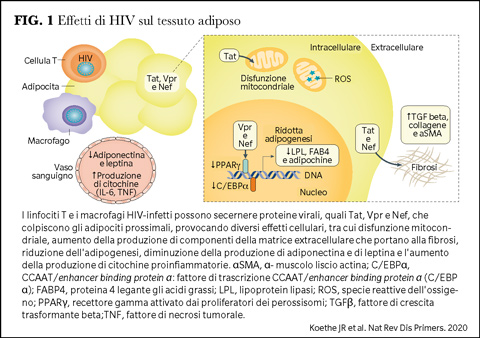 Il progressivo ritorno alla salute dei pazienti in trattamento antiretrovirale, soprattutto se da condizioni di malattia avanzata, deve certamente essere considerato un fattore che contribuisce all’aumento del peso corporeo. Si è infatti osservato che il maggior incremento di peso si registra in quei pazienti che partono da un più basso BMI al basale, da una più bassa conta di CD4 e da una più alta carica virale (1). È stato anche proposto che gli inibitori delle integrasi (INSTI) portino ad un maggior incremento ponderale a causa di una più rapida soppressione della carica virale. Le cellule T e i macrofagi infetti da HIV secernono proteine virali (Tat, Vpr e Nef) che interferiscono con gli adipociti prossimali determinando disfunzioni mitocondriali, produzione di componenti della matrice extracellulare che generano fibrosi, riduzione dell’adipogenesi, della produzione di adiponectina e leptina, aumento della produzione di citochine proinfiammatorie (2) (Figura 1).
Il progressivo ritorno alla salute dei pazienti in trattamento antiretrovirale, soprattutto se da condizioni di malattia avanzata, deve certamente essere considerato un fattore che contribuisce all’aumento del peso corporeo. Si è infatti osservato che il maggior incremento di peso si registra in quei pazienti che partono da un più basso BMI al basale, da una più bassa conta di CD4 e da una più alta carica virale (1). È stato anche proposto che gli inibitori delle integrasi (INSTI) portino ad un maggior incremento ponderale a causa di una più rapida soppressione della carica virale. Le cellule T e i macrofagi infetti da HIV secernono proteine virali (Tat, Vpr e Nef) che interferiscono con gli adipociti prossimali determinando disfunzioni mitocondriali, produzione di componenti della matrice extracellulare che generano fibrosi, riduzione dell’adipogenesi, della produzione di adiponectina e leptina, aumento della produzione di citochine proinfiammatorie (2) (Figura 1).
Inibizione dell’α-melanocyte-stimulating hormone
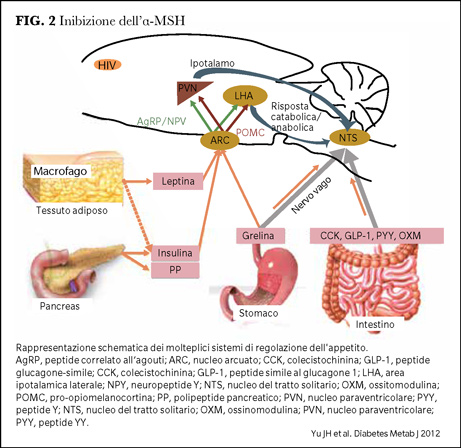 L’α-melanocyte-stimulating hormone (α-MSH) è un neuropeptide che può dare anoressia, prodotto dal processo post trascrizionale della pro-opiomelanocortina (POMC) e rilasciato dai terminali presinaptici dei neuroni POMC. Legandosi ai recettori della melanocortina-3 e 4 (MC3R, MC4R) sui neuroni di secondo ordine, α-MSH attiva meccanismi catabolici, riduce l’assunzione di cibo e aumenta la spesa energetica. La delezione selettiva dei MC4R nel topo porta a iperfagia, riduzione della spesa energetica e obesità. Nell’uomo le mutazioni di MC4R sono responsabili del 6% circa delle obesità severe giovanili (3) (Figura 2).
L’α-melanocyte-stimulating hormone (α-MSH) è un neuropeptide che può dare anoressia, prodotto dal processo post trascrizionale della pro-opiomelanocortina (POMC) e rilasciato dai terminali presinaptici dei neuroni POMC. Legandosi ai recettori della melanocortina-3 e 4 (MC3R, MC4R) sui neuroni di secondo ordine, α-MSH attiva meccanismi catabolici, riduce l’assunzione di cibo e aumenta la spesa energetica. La delezione selettiva dei MC4R nel topo porta a iperfagia, riduzione della spesa energetica e obesità. Nell’uomo le mutazioni di MC4R sono responsabili del 6% circa delle obesità severe giovanili (3) (Figura 2).
Studi in vitro hanno dimostrato che dolutegravir inibisce il legame di α-MSH radiomarcato a MC4R con possibile interferenza con la regolazione dell’assunzione di cibo (4). Uno studio successivo di Mc Mahon e collaboratori tuttavia ha posto in dubbio questa ipotesi dimostrando che sono necessarie dosi di farmaco sostanzialmente maggiori rispetto a quelle assunte ai dosaggi standard (5).
Alterazioni del microbioma intestinale e immunologiche
Sia l’infezione da HIV che l’obesità sono associati ad un’aumentata permeabilità intestinale a batteri e lipopolisaccaride (LPS). In modelli animali, la traslocazione dei prodotti microbici, tra cui LPS, promuove l’infiammazione del tessuto adiposo viscerale (VAT), altera la gestione energetica degli adipociti, e contribuisce all’accumulo di grasso viscerale. Infatti la traslocazione di LPS attraverso la parete intestinale promuove l’attivazione dei macrofagi del tessuto adiposo via recettori CD14, causando uno shift da un fenotipo M2 a un fenotipo M1 e aumenta la produzione di IL-6, TNF e altre citochine proinfiammatorie (2,6-8). L’effetto differenziale degli inibitori dell’integrasi (INSTI) su queste disfunzioni non è al momento chiaro. Alcuni studi suggeriscono che maggiori decrementi nei livelli plasmatici di marker di infiammazione e di immunoattivazione sono evidenti con gli INSTI rispetto agli altri antiretrovirali (9).
Effetti sull’adipogenesi
Particolare attenzione è stata recentemente rivolta agli effetti della terapia antiretrovirale, e soprattutto degli INSTI, sull’adipogenesi. Moure e collaboratori hanno valutato l’effetto in vitro di elvitegravir e raltegravir rispetto a efavirenz su differenziazione, espressione genica e metabolismo di adipociti umani. Dai risultati dello studio è emerso che elvitegravir altererebbe l’adipogenesi e il metabolismo adipocitico in adipociti umani SGBS con un meccanismo concentrazione-dipendente (ritardata acquisizione della morfologia adipocitica e riduzione dell’espressione dei marker di adipogenesi come PPARγ, GLUT4, lipoprotein lipasi, adiponectina e leptina). Rispetto a efavirenz gli effetti di elvitegravir erano simili ma avvenivano a concentrazioni maggiori o erano meno intensi a parità di concentrazione.
In contrasto con questo studio, Gorwood ha osservato che raltegravir aveva un impatto diretto sugli adipociti e, ancor di più, dolutegravir era associato ad accumulo lipidico in cellule adipose staminali e adipociti, suggerendo un ruolo per gli INSTI nell’adipogenesi, nella lipogenesi, nello stress ossidativo e nell’insulino-resistenza (11).
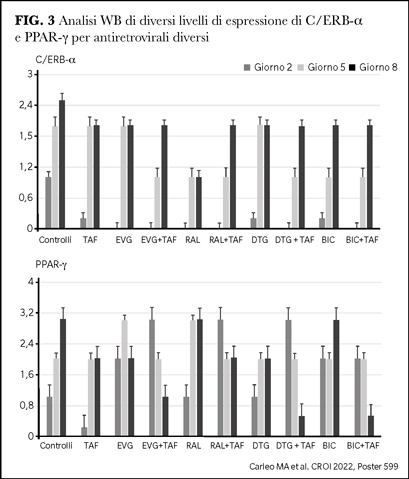 Uno studio italiano è stato condotto da Carleo e collaboratori su un modello in vitro per valutare gli effetti di TAF da solo o in associazione con raltegravir, elvitegravir, dolutegravir e bictegravir sulla differenziazione adipocitica. I livelli di espressione di PPAR-g (peroxisome proliferator-activated receptors) e C/EBP-a (CCAAT/enhancer-binding proteins) e l’accumulo lipidico intracellulare di Red Oil sono stati utilizzati per monitorizzare la differenziazione adipocitica.
Uno studio italiano è stato condotto da Carleo e collaboratori su un modello in vitro per valutare gli effetti di TAF da solo o in associazione con raltegravir, elvitegravir, dolutegravir e bictegravir sulla differenziazione adipocitica. I livelli di espressione di PPAR-g (peroxisome proliferator-activated receptors) e C/EBP-a (CCAAT/enhancer-binding proteins) e l’accumulo lipidico intracellulare di Red Oil sono stati utilizzati per monitorizzare la differenziazione adipocitica.
Rispetto ai controlli, tutti gli INSTI erano in grado di aumentare l’adipogenesi; in questo, raltegravir ed elvitegravir sembravano più efficienti. TAF inibiva lievemente l’adipogenesi. Usato in combinazione con gli INSTI, TAF era in grado di ridurre gli effetti adipogenetici di tutti e quattro i farmaci, l’effetto era più evidente se TAF era usato in combinazione con dolutegravir e bictegravir (12) (Figura 3).
Un altro studio invece non notava alterazioni metaboliche (espressione di PPAR-g e accumulo di trigliceridi) in adipociti di recente attivazione (13). Dolutegravir diminuiva il consumo di ossigeno nei preadipociti, come espressione di sofferenza mitocondriale e l’esposizione a INSTI aumentava la produzione di lattati nei preadipociti e adipociti maturi. La stessa molecola generava soppressione nella produzione di leptina e adiponectina (14).
Secondo un altro studio, dolutegravir e raltegravir determinavano un’upregulation marginale dell’adipogenesi bianca, mentre dolutegravir e bictegravir sopprimevano l’espressione di UCP1 e l’espressione proteica nella catena di trasporto elettronica e la glicolisi negli adipociti marroni e beige. Dolutegravir inibiva l’azione estrogeno-mediata e la termogenesi in modelli murini in vivo (15).
In una popolazione di pazienti virologicamente controllati l’uso di dolutegravir è risultato associato ad un significativo aumento di peso. Questo effetto era più importante nella fase iniziale, quando dolutegravir era in combinazione a due NRTI, ma persisteva quando i pazienti erano trattati in associazione con solo 3TC e non era correlato a concentrazioni di valle del farmaco. Secondo gli autori questi risultati suggeriscono che altri fattori diversi dalla concentrazione del farmaco sono coinvolti nel fenomeno del weight gain in pazienti trattati con dolutegravir (16).
Disturbi psichiatrici
Nello studio TRIO è stato ipotizzato che gli INSTI possano essere associati alla esacerbazione di disordini neuropsichiatrici preesistenti e al conseguente uso di farmaci psichiatrici che notoriamente generano aumento di peso nella popolazione generale. Lo studio ha evidenziato che la presenza di disordini neuropsichiatrici era il solo fattore correlato indipendentemente ad un aumento di peso superiore al 3% dopo un anno di terapia soppressiva con ART (17).
La resistina è una adipochina proinfiammatoria che gioca un ruolo chiave nella risposta insulinica dei tessuti periferici e del Sistema Nervoso Centrale. Uno studio ha ipotizzato il ruolo della regione promoter del gene della resistina umana (RETN-420) nell’aumento di peso in pazienti in terapia con INSTI. è stato suggerito il ruolo potenziale della resistina nel mediare tra INSTI, sintomi a livello di SNC e aumento di peso (18).
Rebound post tossicità da vecchia ART
È noto che alcuni farmaci antiretrovirali oggi molto meno impiegati, come efavirenz, determinavano in passato calo ponderale. In pazienti trattati con questo farmaco è ipotizzabile che il passaggio a INSTI possa determinare un auspicato guadagno ponderale.
Una dimostrazione indiretta è stata fornita da uno studio di Leonard e collaboratori in cui si osserva che, in pazienti ART experienced in terapia con efavirenz che presentavano il gene della metabolizzazione lenta di CYP2B6, quindi in cui l’effetto di tale farmaco persisteva più a lungo, lo switch a INSTI era associato a minor aumento di peso. In questo studio però l’effetto si annullava se efavirenz era assunto in combinazione con abacavir (19). Un altro studio tuttavia non evidenziava alcuna associazione tra livelli di CYP2B6 e tasso di incremento ponderale (20).
Conclusione
Da questa breve e purtroppo inevitabilmente non esaustiva revisione dell’attuale letteratura sulla problematica dell’incremento ponderale in corso di terapia antiretrovirale, possiamo concludere che gli studi attualmente disponibili, pur essendo molteplici, danno risultati talvolta contraddittori, e i molti fenomeni osservati in vitro sono spesso di difficile interpretazione e non sempre correlano direttamente con quanto osservato in vivo.
Quello che appare evidente è la multifattorialità del fenomeno ed il fatto che l’effetto dei farmaci può spiegarlo solo in parte.
Non dobbiamo infine dimenticare che, nella popolazione generale, l’incremento ponderale è un disturbo di rilevanza pandemica, prevalentemente determinato da stili di vita scorretti, spesso ancor più accentuati nei pazienti che vivono con HIV. Sono necessari ulteriori dati che correlino le evidenze di laboratorio con quanto si osserva sui pazienti, anche al fine di evitare i molti fattori comportamentali e ambientali che rendono ancor più difficile studiare e intervenire su questa nuova comorbilità dei nostri pazienti.
Take-home messages
- L’incremento ponderale in corso di terapia antiretrovirale è un argomento la cui patogenesi non è ancora chiarita e che sta focalizzando negli ultimi anni l’attenzione di molti ricercatori.
- La sua eziopatogenesi è, con ogni probabilità, multifattoriale. Entrano probabilmente in gioco fenomeni quali il ritorno alla salute, l’inibizione dell’α-melanocyte stimulating hormone, l’alterazione del microbioma intestinale ed alcune alterazioni immunologiche, gli effetti dei nuovi farmaci antiretrovirali sull’adipogenesi, i disturbi psichiatrici e l’uso di farmaci per la loro terapia e il rebound degli effetti collaterali da vecchi farmaci antiretrovirali, come efavirenz, che determinavano calo ponderale.
- Non dobbiamo infine dimenticare che, nella popolazione generale, l’incremento ponderale è un disturbo di rilevanza pandemica, prevalentemente determinato da stili di vita scorretti, spesso ancor più accentuati nelle persone che vivono con HIV.
- Godfrey C et al. Obesity and Fat Metabolism in Human Immunodeficiency Virus-Infected Individuals: Immunopathogenic Mechanisms and Clinical Implications. J Infect Dis. 2019;220(3):420-431.
- Koethe JR et al. HIV and antiretroviral therapy-related fat alterations. Nat Rev Dis Primers. 2020;6(1):48.
- Yu JH et al. Molecular mechanisms of appetite regulation. Diabetes Metab J 2012;36:391-398.
- Committee for Medicinal Products for Human Use (CHMP). European medicines agency. Assessment report. Dolutegravir (Tivicay). November 21, 2013.
- McMahon C et al. Lack of an association between clinical INSTI-related body weight gain and direct interference with MC4 receptor (MC4R), a key central regulator of body weight. PLoS ONE. 2020;15:e0229617.
- Godfrey C et al., J Infect Dis. Obesity and Fat Metabolism in Human Immunodeficiency Virus-Infected Individuals: Immunopathogenic Mechanisms and Clinical Implications. 2019;220(3):420-431.
- Cani PD, et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 2007; 56:1761–72.
- Liu R, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nat Med 2017; 23:859–68.
- Bai F. et al. Associations between weight changes and plasmatic pro-inflammatory cytokines in PLWH following ART initiation: data from the ICONA cohort. ICAR 2021 OC 47.
- Moure R, et al. Impact of elvitegravir on human adipocytes: Alterations in differentiation, gene expression and release of adipokines and cytokines. Antiviral Res. 2016;132:59–65.
- Gorwood J, et al. The Integrase Inhibitors Dolutegravir and Raltegravir Exert Proadipogenic and Profibrotic Effects and Induce Insulin Resistance in Human/Simian Adipose Tissue and Human Adipocytes. Clin Infect Dis. 2020;71(10):e549-e560.
- Carleo MA et al. Adipocyte differentiation and antiretroviral drugs: an in vitro model. CROI 2022, Poster 599.
- Taylor Pickering R. et al. Metabolic perturbations by integrase inhibitors in differentiated human adipocytes. CROI 2022 Poster 600.
- Taylor Pickering R. et al. In vitro model to assess antiretroviral therapy on adipocyte biology. CROI 2021 abstract 514.
- Jung I et al. Integrase inhibitors target mitochondria in brown adipocytes disrupting thermogenesis. CROI 2021, Abstract 515.
- Burdet C et al. Drug concentrations and body gain in PLWH switched to 3TC and dolutegravir. CROI 2020, Abstract 677.
- McComsey G, et al. Weight gain during treatment among 3,468 treatment-experienced adults with HIV. CROI 2019, Abstract 671.
- Minami R. et al. Resistin gene polymorphism related to weight gain and psychiatric symptoms on InSTI. CROI 2020, Abstract 670.
- Leonard MA, et al. Efavirenz Pharmacogenetics and Weight Gain Following Switch to Integrase Inhibitor-Containing Regimens. Clin Infect Dis 2021;73(7):e2153-e2163.
- Haas DW et al. Pharmacogenetics of weight gain after switch to integrase inhibitor-based regimens. CROI 2022 Poster 595.






